Российская академия наук
Институт прикладной физики
Научно-образовательный центр ИПФ РАН
С. Б. Парин ОСОБЕННОСТИ БИОЭЛЕКТРОГЕНЕЗА
Принципы
переработки информации
в нервной системе
Методическое пособие
Нижний Новгород
Издательство ИПФ РАН
2009
УДК 573
ББК 28.707.3
Р е ц е н з е н т ы
К.В.Анохин,
член-корреспондент РАН и РАМН, доктор медицинских наук, зав. лабораторией нейробиологии памяти Научно-исследовательского института нормальной
физиологии им. П.К.Анохина РАМН;
Д. Б. Гелашвили,
доктор биологических наук, профессор, зав. кафедрой экологии биологического
факультета ННГУ им. Н.И.Лобачевского;
В. Г. Яхно,
доктор физико-математических наук, зав. лабораторией автоволновых процессов ИПФ РАН.
П18 Парин Сергей Борисович
Особенности биоэлектрогенеза. Принципы переработки информации в нервной системе: Методическое пособие. ― Нижний Новгород: Изд-во ИПФ РАН, 2009. ― 72 с. ISBN
Данное методическое пособие обобщает тридцатилетний опыт чтения автором различных нейробиологических курсов студентам технических, биологических, медицинских и психологических специальностей. В максимально образной форме описаны базовые принципы передачи информации в нервной системе с помощью электрических сигналов.
Предназначено для представителей физико-математических специальностей, а также психологов, биологов и медиков, изучающих введение в механизмы переработки информации в нервной системе и желающих разобраться в основах биоэлектрогенеза в нервных тканях, то есть начинающих свой путь в современной нейробиологии.
ISBN 978-5-8048-0068-1 © Институт прикладной физики РАН, 2008.
© Парин С. Б., 2008.
Книжка, которую Вы держите в руках, написана как своеобразный самоучитель для тех, кто хочет разобраться в основах биоэлектрогенеза в животных тканях (прежде всего, в нервной системе животных). Она не претендует на глубину анализа, у неё совсем другая задача: дать начинающим свой путь в нейробиологии физикам, химикам, психологам, медикам и (как это ни грустно) биологам стартовую площадку, базу для дальнейшего погружения.
Думаю, Вы уже успели заметить, что учебная литература бывает двух типов. По первому типу написаны немногочисленные (в основном, увы, неотечественные) учебники, авторы которых просто и внятно описывают те сложные закономерности, в выявлении которых им посчастливилось участвовать самим. В таких книжках легко дышится и продуктивно думается. Второй тип представляют бесконечно переписываемые из издания в издание нагромождения фактов и гипотез, многие из которых по ходу дела возводятся в ранг фундаментальных теорий, каковыми ни в коей мере не являются. Эти книжки опасны для доверчивого читателя, потому что создают иллюзию всепознанности и становятся питательной средой для всяческого парарелигиозного мракобесия. «Учёные показали…» ― эта очень страшная фраза переселилась в многочисленные рекламные клипы именно из вполне наукообразной учебной литературы.
Нейробиологии в этом смысле, казалось бы, повезло. Есть прекрасные отечественные издания, написанные признанными в мире классиками «жанра»: это и многократно переиздававшиеся учебники П. Г. Костюка, и книжки П.К.Анохина, А. Б. Когана, В. В. Шульговского, Б. И. Ходорова, А. Д. Ноздрачёва, О. А. Крышталя и многих других, и известные нам благодаря переводам труды Э. Кэндела, К. Прибрама, Ф. Блума, В. Маунткастла, Д. Эдельмана, Г. Шеперда, Д. Экклза, С. Куффлера… Казалось бы, бери и читай! Замечательно, но есть одно «НО»: эти прекрасные книги рассчитаны на уже подготовленного читателя. Значит, есть такая задача – подготовить заинтересованного читателя (независимо от его первоначального образования) к их восприятию.
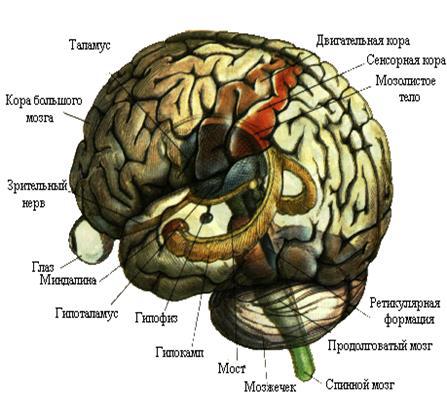
Автор ни в коем случае не гарантирует абсолютной доказанности всех изложенных в пособии научных фактов (здесь найдётся место и гипотезам), однако обещает приложить все усилия, чтобы отделить то, что реально промерено, от того, что является результатом игр разума, пусть и очень красивых. И ещё: я постараюсь не пугать читателя страшными словами там, где можно обойтись простым человеческим языком. Мне хотелось, чтобы получился спокойный разговор с читателем. В конце концов мы ведь будем говорить о том, что смогли открыть, увидеть люди, пытаясь заглянуть в наш мозг (рис. 1). Неужели вместе мы не сможем это понять?
Завершая введение, хочу поблагодарить старшего научного сотрудника ИПФ РАН, доктора биологических наук Софью Александровну Полевую за помощь на всех этапах выполнения этой работы.

Рис. 1. Так выглядел бы наш мозг, если бы мы могли видеть его насквозь. Впрочем, современные томографические методы позволяют это проделывать (пусть и путём компьютерной реконструкции).
Возбудимые клетки
Мир, в котором мы все живём, бескрайне многолик и изменчив. Его лица и изменения могут быть прямо обращены к нам, но могут существовать и независимо от нас. в любом случае, как только мы хоть краешком своего Я прикасаемся к этому миру, мы входим с ним во взаимодействие, и должны иметь устройства (аппараты, приборы, системы…), обеспечивающие эффективность этих взаимодействий. первым и главным из этих устройств является наша нервная система. Её задача — собирать информацию из внешнего мира, обрабатывать её и, сопоставив её с накопленным раньше опытом, принимать управленческие решения: как реагировать, и реагировать ли вообще. То есть наша нервная система — это информационная система со всеми её атрибутами. А раз так, должен быть язык, код, правила, по которым записывается информация.
Вот мы и добрались до биоэлектрогенеза, до особенностей возникновения электрических процессов в живых системах. Подозрение о том, что базовым, первичным кодом в нервной системе (подобно двоичному коду любого компьютера, где 00, 01, 11 или 10 удивительным образом ухитряется вместить все помыслы писателя, поверяемые им машине) может быть импульсный код, то есть определённая последовательность нервных (по сути, электрических) импульсов, возникло не на пустом месте. Ещё в конце XVII века в ожесточённом споре двух великих физиков — Луиджи Гальвани и Александро Вольта — родилась первая истина на этом долгом пути: в теле животных (и человека, естественно) есть электрические потенциалы и электрический ток. Потребовалось два с лишним века, чтобы мы начали понимать, что именно эти биоэлектрические явления и дают возможность нервной системе работать с информацией, и ещё почти век, чтобы начать понимать, как это происходит. Давайте обсудим, что мы сегодня знаем об этом.
Есть устойчивое мнение, что способностью к биоэлектрогенезу обладают только некоторые клетки животных, которые принято называть возбудимыми. Честно говоря, это не совсем правда! Сегодня уже хорошо известно, что электрический заряд на мембране имеют и клетки крови (например, эритроциты), и гепатоциты (то есть клетки печени), и половые клетки животных, и т.д. Более того, некоторые клетки растений тоже способны к генерации электрического заряда на своей поверхности, причём этот заряд меняется и распространяется, что позволяет биофизикам уже полвека говорить о наличии у растений нервной системы (тех, кто, в отличие от ботаников, наблюдал растения в реальной жизни, а не в гербарии, это едва ли удивит).
Тем не менее, клетки нервной, эндокринной и мышечной систем традиционно относят к особой группе, называя их (и только их) возбудимыми. Почему же? Ответ начнём с формулирования очень важного в нейробиологии понятия возбудимости. Одно из наиболее точных определений звучит так: возбудимость — это способность некоторых клеток (нервных, мышечных, эндокринных) отвечать на действие стимула закономерными изменениями электрического потенциала своей мембраны. То есть при действии какого-то раздражителя (напомним, что стимул — это вообще-то острый прутик, которым арбакеша побуждает заупрямившегося ослика к началу движения, раздражающий фактор) на мембране этих клеток однотипно, принципиально сходным образом меняются характеристики заряда. А чтобы что-то менять, надо это иметь. Стало быть, возбудимые клетки изначально, ещё до нанесения стимула, обладают зарядом мембраны. Попробуем разобраться, откуда же он берётся и как и почему он может меняться.
Для ответа на поставленный только что вопрос нам придётся вспомнить некоторые данные из анатомии, гистологии, цитологии, химии (биохимии в том числе) и физики. Привычнее всего обратиться к нейрону, как функциональной единице нашего мозга. Вспомним, что в нейроне различают сому (или тело клетки), дендриты — как правило (но далеко не всегда!), многочисленные обильно ветвящиеся относительно короткие отростки, и аксоны — как правило (тоже не всегда), относительно длинные маловетвящиеся одиночные отростки, заканчивающиеся пресинаптическими окончаниями, контактирующими со следующими возбудимыми клетками (рис. 2). В центральной нервной системе человека (ЦНС) обнаружено 1011 — 1012 нейронов. Если учесть, что каждый нейрон в среднем принимает по 1000 синаптических входов (а у некоторых количество таких входов более десяти тысяч), можно представить себе сверхсложность нашей информационной системы. Кроме того, сегодня доказано участие в обработке информации сопутствующих нейронам глиальных клеток, что ещё больше расширяет возможности мозга.
Но вернёмся к нейронам. Как и положено всякой добропорядочной клетке, нейрон имеет ядро, цитоплазму, митохондрии, комплекс Гольджи, рибосомы и другие органоиды. Наружная поверхность нейрона образована мембраной. Именно она и явится для нас сейчас предметом особого внимания.
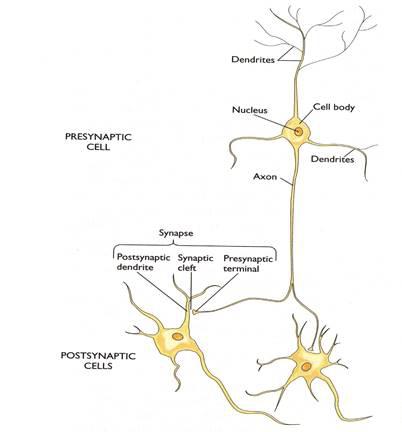
Рис. 2. Изображен весьма правдоподобный нейрональный модуль, состоящий из трёх нейронов. Хорошо видны тела (сомы) этих трёх нервных клеток с ядром внутри каждой, относительно короткие ветвящиеся дендриты и сравнительно длинные аксоны. Обратите особое внимание на два синапса, которыми верхний нейрон связан с двумя нижними клетками: с дендритом левой (аксо-дендритный синапс) и сомой правой клетки (аксо-соматический) (Эта иллюстрация, а также рис. 19, 50 и 56 скопированы из презентации к публичной лекции К.В.Анохина, 2006).
Как известно, клеточная мембрана состоит из двойного слоя липидов (в основном, фосфолипидов), в который встроены различные по структуре, свойствам и функциям белковые молекулы (рис. 3, 4).
Рис. 3. Схематическая реконструкция клеточной мембраны. В хорошо структурированный липидный бислой встроены белковые молекулы, обладающие специфическим строением и специфическими функциями.
Устойчивость липидного бислоя обеспечивается своеобразными свойствами липидных молекул — их полярным отношением к водной среде. Фосфоглицериновая «головка» липидной молекулы гидрофильна, то есть водорастворима (для проверки можете сходить в аптеку и купить водный раствор глицерина), тогда как образованные жирными кислотами «хвосты» гидрофобны, то есть воду категорически не любят и всячески стараются держаться от неё подальше (опять же можете сами попробовать сотворить водный раствор подсолнечного масла, только продуктивнее это время потратить на хорошую книжку). Благодаря этому свойству липидные молекулы в водной среде (а в нашем организме среда-то как раз водная, ведь и цитоплазма, и межклеточная жидкость — это, по сути, водные растворы разных органических и неорганических соединений) стремятся образовывать компактные скопления, мицеллы, в которых гидрофобные полюса молекул обращены друг к другу — подальше от воды, — а гидрофильные «головки» вполне закономерно развёрнуты наружу, взаимодействуя с водой.
|
Рис. 4. Биологоправдоподобное изображение клеточной мембраны. Хорошо видны различные белковые глобулы (в том числе ионные каналы), «плавающие» в двойном слое липидных молекул (Эта иллюстрация, а также рис. 5, 10, 12 – 14, 16, 43 и 52 скопированы из книги Николлса и др. «От нейрона к мозгу», 2003).
Бислойная мембрана — один из примеров такого компактного скопления липидов, очень стабильного, но одновременно текучего (что тоже важно). В самом деле, простейший аналог такой мембраны — янтарная капелька жира на поверхности горячего бульона: и стабильная, и подвижная.
Надеюсь, Вы смогли представить себе эту волнующуюся жировую плёнку на поверхности океана цитоплазмы, а теперь вообразите множество айсбергов, то тут, то там возвышающихся над этой поверхностью. Это белки, а точнее — белковые комплексы. У этих белков разное химическое строение, разные свойства, разные названия, разное место в официальной классификации. Но нам сейчас интересно не это, а то, чем эти белки занимаются на мембране, то есть их функции. Попробуем сгруппировать их именно по функциональному признаку (рис. 5).
| |
|
|
Тогда сразу обнаружится несколько принципиально важных классов белковых молекул (комплексов — повторим ещё раз, потому что, как правило, определённую работу на мембране выполняет не одиночная молекула белка, а молекулярный комплекс, состоящий из нескольких субъединиц) (рис. 6): 1) ионные каналы, 2) ионные насосы, 3) рецепторы, 4) ферменты, 5) структурные белки, и т. д.
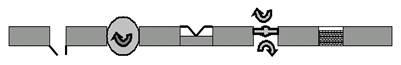
1 2 3 4 5
Рис. 6. Схема клеточной мембраны. В обозначенный серой полосой липидный би-слой встроены 5 функциональных типов белков: 1 — каналы, 2 — насосы, 3 — рецепторы, 4 — ферменты, 5 — структурные белки.
Ограничимся этим перечнем, он пока достаточен для понимания нами основ биоэлектрогенеза. Что же эти белки делают на мембране?
Структурные белки стабилизируют текучий липидный бислой. Трудно предположить, что без них нейрон растечётся по субстрату, подобно часам у Сальвадора Дали, но без белков-стабилизаторов мембраны пока никто не видел.
Ферменты, как известно, — это биологические катализаторы. Они снижают энергию активации, то есть обеспечивают существенно облегчённый старт химических реакций в организме. А вот что это будут за реакции, зависит уже от специфики конкретных ферментов. Нас будут интересовать прежде всего те ферменты, которые катализируют реакции, идущие на поверхности мембраны нейрона, в подмембранном пространстве (в цитоплазме) и так называемые трансмембранные реакции («пронизывающие» мембрану).
Рецепторы — главные коммуникаторы в межнейронной передаче. Эти белки способны с высоким сродством (то есть очень специфично и в относительно низких концентрациях) связываться с биологически активными веществами (медиаторами, гормонами и т.д.) и, переходя в активированное состояние, изменять физиологическую активность принимающей информацию клетки, в первую очередь — менять электрические характеристики мембраны этой клетки.
Ионные каналы и насосы — это транспортные белки, обеспечивающие перенос ионов через мембрану возбудимой клетки. При этом каналы пропускают ионы по их градиенту концентрации; это пассивный транспорт, не требующий энергетических затрат. В противоположность этому насосы переносят ионы против градиента концентрации, затрачивая на эту работу энергию АТФ (универсального клеточного аккумулятора энергии). Такой транспорт является активным.
Рассмотрим подробнее функции каналов и насосов, ведь именно их работа обеспечивает формирование и изменение зарядов мембраны. Определяя особенности функционирования этих транспортных белков, мы использовали очень важное понятие: химический градиент ионов. Хочется напомнить, что в растворе молекулы диссоциируют на ионы. Наш организм, на 70% состоящий из воды, не исключение: в нём присутствуют и неорганические ионы (Na+, K+, Ca2+, Cl– и т.д.), и органические (например, белковые анионы). При этом распределение этих ионов по разные стороны мембраны далеко не одинаково. Так, в межклеточном пространстве чрезвычайно высока концентрация катионов Na+ и Ca2+, а также анионов Cl–. В цитоплазме этих ионов, наоборот, очень мало, зато там высоки концентрации катионов K+, а также белковых анионов. Таким образом, мы видим, что мембрана возбудимых (да и не только возбудимых) клеток разделяет две химически неоднородные среды (внутри клетки и снаружи) с существенно разными концентрациями ионов (рис. 7). То есть на мембране можно обнаружить (померить) химический градиент.
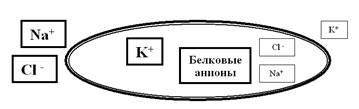
Рис. 7. Схема иллюстрирует ярко выраженное неравновесие ионов по разные стороны мембраны. Внутри клетки явно выше концентрация K+ и белковых анионов, а снаружи преобладают ионы Na+ и Cl–.
А теперь представьте себе простой опыт. Небольшой аквариум разделён пополам непроницаемой перегородкой. Перегородка состоит из двух слоёв: стеклянной пластинки (абсолютно непроницаемой для исследуемых нами веществ) и полимерной плёнки, через микроскопические поры которой могут проходить ионы какого-то одного вида.
Наливаем в левую половинку аквариума концентрированный раствор интересующего нас вещества (например, простой поваренной соли, которая в водной среде диссоциирует на ионы: NaCl « Na++Cl-), а в правую — такой же раствор, но очень разбавленный (рис. 8).
Рис. 8. Выравнивание концентраций вещества в растворах, разделённых полупроницаемой перегородкой. Ионы через каналы (поры) просачиваются по градиенту концентрации.
Очевидно, что любые доступные способы измерения покажут наличие существенной разницы концентраций (наличие химического градиента) этого вещества по разные стороны перегородки. Убедившись в этом, выдёргиваем стеклянную перегородку. Остаётся только полупроницаемая полимерная мембрана. Очень скоро мы сможем убедиться, что концентрации по обе стороны мембраны начали выравниваться: ионы по градиенту концентрации начали перебираться из более концентрированной среды в менее концентрированную. Понадобилась для этого дополнительная энергия? Нет, достаточным оказалось предоставить системе возможность самостоятельно решить «проблему социальной справедливости» (всех уравнять!), разблокировав каналы утечки. Именно каналы, ведь через них идёт пассивный транспорт, не требующий дополнительной энергии, по градиенту.
А вот теперь представим себе обратную задачу: нам надо вернуть исходное состояние неравновесия концентраций в нашем аквариуме (рис. 9). Понятно, что без затрат энергии это не получится (попробуйте достать воду из колодца, не прилагая усилий!). Именно поэтому перекачка ионов против градиента концентрации — работа уже не каналов, а насосов, и на эту работу расходуется энергия АТФ (между прочим, электронасос накачает Вам ведро воды мигом, но посмотрите на счётчик — сколько энергии Вы сожгли!).
Рис. 9. Для создания химического градиента требуется приложить энергию. Используя энергию распада АТФ, насосы перекачивают ионы против градиента концентрации.
Мы коснулись чрезвычайно важных моментов в проблеме биоэлектрогенеза. Проанализируем эти два механизма ионного транспорта детальнее. Во-первых, как устроены ионные каналы? Принятая сегодня модель ионного канала основывается на множестве достаточно убедительных, но всё же косвенных измерений. Хочется ещё раз предостеречь читателей от популярного заблуждения: на самом деле очень многое из того, что мы знаем о микроорганизации нейронов (на молекулярном, мембранном уровнях), является результатом мысленных, технических, компьютерных, математических и т.п. реконструкций объектов по многочисленным физико-химическим измерениям; то есть это гипотетические модели объектов, а вовсе не сами объекты, как может показаться из ряда современных книжек.
Поэтому используемые повсеместно в нейробиологии словосочетания «селективная пора», «ворота» и т.д. нужно понимать как более или менее удачные метафоры, а не как прямое описание объектов (в данном случае — каналов). Унывать, однако, не вижу оснований: технологическая база исследований развивается очень быстро, и то, что недоступно сегодня, становится рутинной повседневностью завтра. Надеюсь, что скоро сможем убедиться в правильности (или неправильности) модельных реконструкций, в том числе и моделей каналов. Подождём немного?
Так вот, согласно принятой сегодня модели ионные каналы — это белковые комплексы, состоящие из нескольких субъединиц — молекул белка (рис. 10). Эти белковые комплексы пронизывают липидную мембрану насквозь, что и позволяет происходить трансмембранному переносу ионов.
|
Рис. 10. Реконструкция ионного канала, встроенного в липидную мембрану. Изображены белковые субъединицы, образующие селективную пору (внутри которой красуется одинокий гидратированный ион) и закрытые в настоящий момент ворота (G — gate = ворота). |
В канале выделяют два функциональных компонента (рис. 11): селективную пору, обеспечивающую выбор (селекцию) тех ионов, которые этот конкретный канал может пропускать, и так называемые ворота, которые обеспечивают дискретность (прерывность) работы канала (как правило, канал активируется только на очень короткий промежуток времени, всё остальное время он закрыт и ионы не пропускает).
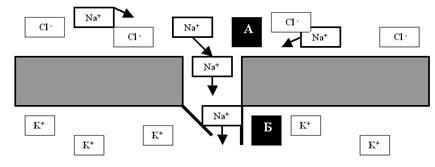
Рис. 11. Условная схема, иллюстрирующая работу ионного канала. А — селективная пора, через которую у данного вида канала диффундируют только ионы Na+, тогда как ионы Cl– и K+ сквозь мембрану не проходят. Б — ворота; у данного вида канала в данный конкретный момент времени активационная створка ворот (слева) полуоткрыта, а инактивационная (справа) открыта полностью. Напоминаю, что и селективная пора, и ворота — не более чем относительно удачная метафора.
Нет времени (да и необходимости) рассматривать многочисленные гипотезы, объясняющие тонкие электрохимические механизмы функционирования обоих компонентов канала. Гораздо более важным является то, что эти механизмы обеспечивают высокую специфичность работы каналов. Существуют каналы Na+, K+, Ca2+, Cl– и др., то есть благодаря отбору в селективной поре эти каналы избирательно пропускают только один из перечисленных видов ионов, препятствуя транспорту остальных.
Необходимо подчеркнуть, что эта селективность, избирательность не является абсолютной: как и положено живой системе, каналы имеют право на ошибку и могут случайным образом пропускать и «неправильные» ионы, однако их доля в общем ионном токе незначительна. Принято различать высокоселективные каналы (например, на мембране аксона — Na+ или K+) и низкоселективные (например, на постсинаптической мембране — Na+— K+ или Cl– — K+).
Воротный механизм (или просто ворота) — второй функциональный компонент ионного канала. Естественно, ворота — это весьма вольная метафора, однако она вполне отражает задачу этого механизма: переводить канал из закрытого состояния в открытое и наоборот — снова
закрывать его. На самом деле, состояние канала определяется кон-формацией (III структурой) образующих его белковых молекул, а конформация, в свою очередь, зависит от энергетики этих молекул.
В принципе любое воздействие, изменяющее энергетическую характеристику белка (электрическое поле, повышение или снижение температуры, сдвиги рН и ионного состава, механическое воздействие, химические взаимодействия и т. д.), может вызывать и изменение его конформации. Однако специфика канальных белков в том, что изменения конформации, приводящие именно к активации («открыванию») канала, возникают только на очень специфичные, эксклюзивные для данного типа каналов воздействия. Так, есть каналы, эффективная активация которых возможна только при изменении электрического поля на мембране — их называют потенциалзависимыми (или, по старинке, электровозбудимыми); есть каналы, открывающиеся только по химическому «приказу» от рецептора — это лигандзависимые каналы (лиганды в нейробиологии — вещества, с высоким сродством связывающиеся с данным конкретным рецептором и изменяющие его функциональное состояние, о лигандах мы поговорим подробно чуть позже; химика это определения приведёт в трепет!); есть удивительные каналы, активирующиеся в ответ на механическое воздействие — нетрудно догадаться, что они называются механозависимыми; наконец, особый тип каналов — поры, у них ворота загадочным образом куда-то потерялись (точнее, их вообще никогда не было), поэтому осталась одна селективная пора, которая открыта всегда, независимо от энергетических проблем (рис. 12, 13).
|
Рис. 12. Наиболее вероятное устройство ионного канала с учётом особенностей строения белковых субъединиц. |
Это очень упрощённая классификация (по транспортируемым ионам и механизму активации). Так как сегодня обнаружено более 150 видов каналов, существуют и более глубинные принципы объединения каналов в группы, учитывающие целый ряд дополнительных факторов, но мы в эти подробности вдаваться не будем.
|
Рис. 13. Возможный механизм активации потенциалзависимого ионного канала: изменение заряда мембраны (обратите внимание на изменение плюсов и минусов по разные стороны липидной мембраны) меняет конформацию белковых доменов, переводя закрытый канал (А) в открытое состояние (В) |
Единственное, на что хотелось бы обратить внимание, — это существование не только активационных, но и инактивационных ворот. Вопреки бытующему мнению задача этих ворот состоит вовсе не в закрывании ионного канала, а в переводе его в такое состояние, в котором он определённое время не может активироваться. Подобный механизм есть далеко не у всех каналов, но обнаружен, например, у потенциалзависимых Na+-каналов мембраны аксона.
Второй механизм ионного транспорта, который мы обозначили, —активный транспорт с помощью насосов.
Мембранных насосов известно много (рис. 14). Они могут иметь разную молекулярную структуру, но функция у них одна и та же: перенос веществ (молекул, ионов, протонов… — не принципиально) против градиента концентрации данного конкретного вещества. Стало быть, такой перенос требует затрат энергии. Как правило, источником энергии является АТФ.
|
Рис. 14. Разные виды транспортных белков, обеспечивающих активный трансмембранный перенос веществ. (А) — Na+-K+-АТФаза, (В) — Na+- Ca2+-насос, (С) — Cl-- K+- насос, (D) — моноаминовый транспортер. |
Напомним, что аденозинтрифосфат (АТФ) — уникальный по своей безотказности молекулярный аккумулятор энергии. При расщеплении макроэргических (высокоэнергетичных) связей между остатками фосфорной кислоты и соответственно частичном разрушении молекулы АТФ выделяется поразительное для такой субмикроскопической структуры количество энергии, идущей на «хозяйственные нужды» клетки. При этом аккумулятор, естественно, разряжается (АТФ→АДФ), а на его зарядку (восстановление целостности молекулы АТФ) требуется чуть больше энергии, чем было получено при распаде. Откуда берётся эта энергия? По крайней мере, отчасти мы едим для «зарядки» АТФ (отчасти, потому что с едой мы ещё поставляем клеткам стройматериалы, а иногда ещё и получаем удовольствие), а уж дышим и вообще только ради этого.
Но вернёмся к насосам. Попробуем понять принцип их работы на примере так называемой Na+-K+-помпы, которая обеспечивает уже обсуждавшееся нами неравновесие ионов Na и K+ по разные стороны мембраны нейрона. Более или менее убедительно показано, что этот насос представляет собой достаточно тяжёлый белок, обладающий, как минимум, двумя активными конформациями, в одной из которых (назовём её X) он имеет повышенное сродство к ионам Na+, а в другой (пусть будет Y) — к ионам K+. На рис. 15 показана очень упрощённая схема работы Na+-K+-помпы.
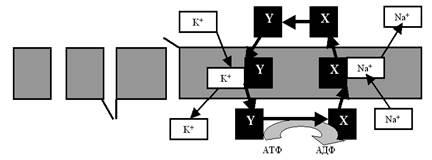
Рис. 15. Условная схема, иллюстрирующая механизм работы ионного насоса. В качестве примера представлена Na+-K+-помпа. Объяснения в тексте.
В подмембранном пространстве белок-транспортер в конформации X связывается с ионом Na+ и переносит его на наружную поверхность возбудимой клетки (при этом удаётся «обмануть» градиент Na+, который, как вы помните, направлен внутрь). Там белок расстаётся с Na+ и переходит в конформационное состояние Y. Теперь «на борт» берётся уже ион K+ (снова обманут градиент, ведь K+ транспортируется через мембрану в связанном с белком виде — это другое вещество, совсем не K+!), и челнок ныряет внутрь клетки. Здесь — скорое расставание с K+ и возвращение в конформацию X. Круг (цикл) замкнулся.
А куда же уходит энергия АТФ? Вспомните, мы говорили о том, что у белков определённому уровню внутренней энергии соответствует определённое конформационное состояние. Отсюда и решение обратной задачи: если конформация изменилась, значит, что-то произошло с энергетикой белковой молекулы, то есть энергия АТФ расходуется на конформационные изменения.
И вот здесь очередная демонстрация фантастического совершенства жизни: оказывается, энергетической подпитки требует только переход Y®X (внутри клетки), а обратное изменение конформации (X®Y) происходит самопроизвольно. Объяснение очевидно: состояние Y энергетически более выгодно для данного белка-транспортера (в этом конформационном состоянии у него меньше свободной энергии, он менее возбуждён), чем состояние X. Таким образом, получается, что энергия АТФ тратится только на внутриклеточный переход Y®X. Мало того, работа помпы настолько экономична, что одна молекула АТФ обеспечивает перекачку через мембрану сразу 5 ионов (3+2), то есть 2,5 «оборота» насоса. Этому способствует и так называемая электрогенность насоса, его способность использовать, кроме АТФ, и энергию электрических зарядов, формирующихся на мембране.
Если после чтения предыдущей пары страниц Вам всё ещё кажется, что такое объяснение работы насоса слишком уж мудрено, взгляните на рис. 16: идея-то та же, просто графически представлена в другом, уже знакомом Вам виде. Думаю, Вы без труда сами проследите всю цепочку событий. Только ещё раз прошу не забывать, что это всего лишь более или менее правдоподобные модели: не будете же Вы всерьёз думать, что ионы так похожи на шарики для пинг-понга?!
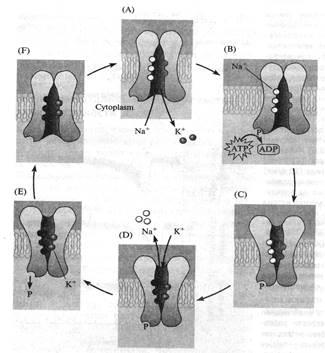
Рис. 16. Ещё одна иллюстрация на тему Na+-K+-помпы. Попробуйте самостоятельно пройти по всему циклу A-B-C-D-E-F-A.
4. Мембранные потенциалы: ПП, ПД, ВПСП, ТПСП, МПКП, ПКП и т. д.
Любого здравомыслящего читателя набор аббревиатур, вынесенных в заголовок этой главы, должен привести в чрезвычайно унылое состояние. Просим набраться терпения: очень скоро Вы увидите, что всё не так мрачно, как кажется с первого взгляда.
Прежде всего речь в этой главе пойдёт о главной электрической составляющей информационных процессов в нервной системе и в возбудимых тканях вообще. Мы будем отвечать на вопрос, поставленный в конце главы 1: что такое мембранный потенциал и как и почему он может меняться?
Напомним, что главным «языком» мозга является язык нервных импульсов, или импульсный код (рис. 17).

Рис. 17. Простая имитация импульсной активности нейрона, созданная с помощью всего двух клавиш компьютера. Можно утверждать, что при наличии соответствующей регистрирующей аппаратуры сейчас, в это мгновение, в Вашей голове можно было бы обнаружить нейрон, разряжающийся именно в таком режиме.
На рисунке хорошо видно, что после каждого импульса возникает пауза, которая иногда длится мгновение, сопоставимое по длительности с самим импульсом, а иногда растягивается на довольно солидный отрезок времени. Эта пауза называется межимпульсным интервалом и отражает состояние относительного покоя мембраны клетки. Заметим, что чередование импульсов и межимпульсных интервалов (так называемый рисунок паттерна) является одним из возможных кодов нейрона, хотя его роль в обработке информации, судя по всему, весьма невелика. Для нас же сейчас важно выяснить, каким электрическим характеристикам мембраны соответствует состояние её покоя и активности (в момент генерации импульса).
4.1. Потенциал покоя (ПП) мембраны и причины его возникновения
Постарайтесь представить себе достаточно несложный по сегодняшним возможностям эксперимент. Прежде всего, что Вы будете делать, чтобы померить напряжение в сети, от которой питается Ваша настольная лампа? Думается, многим из Вас знаком прибор под названием тестер (официально он называется омампервольтметр или как-то похуже), в котором есть непосредственно измеритель (в простейшем варианте струнный гальванометр) и два провода — электрода, кончики которых мы можем аккуратно ввести в электрическую розетку. Обнаружив, что измеритель показал 205—210 В (на 220 рассчитывать не очень приходится, учитывая, что в нашей стране всё воруют), мы сразу успокаиваемся: напряжение измерено. А теперь представьте себе, что Вам надо померить напряжение (давайте начнём пользоваться более «физиологичным» понятием — потенциал) на мембране нейрона. Принцип-то измерения будет точно таким же: нужен измеритель и нужны электроды. Только надо учесть миниатюрность всего того, что мы собрались измерять, поэтому и электроды будут особо тонкими (микроэлектроды), и сам измеритель гораздо чувствительнее, чем для бытовых нужд. Ведь в нейронах (забегаем вперёд) потенциалы на 3 порядка слабее, чем в розетке: милливольты (мВ), а не вольты.
Как раз теперь самое время поговорить о методах измерений электрических процессов в живых системах. В принципе не так уж и важно, что мы меряем: потенциалы отдельных нейронов (или даже участков их мембраны), их больших или сравнительно небольших скоплений — модулей (так называемые фокальные потенциалы), суммарные потенциалы больших участков мозга (например, ЭЭГ — электроэнцефалография), потенциалы сердца (ЭКГ — электрокардиография), или что-то другое. Подход к измерениям достаточно стандартен (рис. 18).
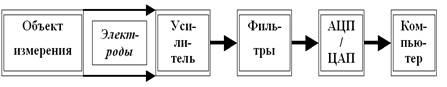
Рис. 18. Принципиально необходимые компоненты современной электрофизиологической аппаратуры (объяснения в тексте).
Нужны электроды для отведения потенциала от объекта измерения. Если объект маленький, используются микроэлектроды (как правило, стеклянная микропипетка, заполненная каким-то электролитом, например, KCl), если покрупнее — макроэлектроды. Так как потенциалы и токи в живых системах очень слабы, необходимо уметь их усиливать при регистрации. Поэтому во всей электрофизиологической аппаратуре есть специальные усилители. При усилении сигнала возникает серьёзная проблема: вокруг нас очень много всяческих электрических и радиотехнических приборов (радиотелефоны, телевизоры, пылесосы, трамваи и прочие достижения цивилизации), создающих массу помех; «шумят» и живые клетки. Усиливая интересующий нас сигнал, мы автоматически усиливаем и сопровождающие его шумы. И здесь есть опасность вообще потерять сигнал в этом море помех.
Поэтому в современных электрофизиологических приборах обязательно присутствуют специальные фильтры, позволяющие вырезать сигнал из шума. И, наконец, зарегистрированный, усиленный и очищенный от помех сигнал надо как-то увидеть и зафиксировать, то есть сохранить. Так как сегодня аппаратура для измерений компьютерная, с этим проблем нет. Надо только преобразовать те электрические изменения, которые мы поймали нашими электродами (так называемый аналоговый сигнал), в цифровую форму, понятную компьютеру. Это умеют проделывать АЦП — аналогово-цифровые преобразователи (есть, кстати, и обратные преобразователи — ЦАП). Теперь уже ничто не помешает увидеть зарегистрированные биопотенциалы на экране монитора компьютера, записать их в память, обработать любым способом и т. д.
Однако вернёмся к нашему эксперименту. Представьте себе, что мы получили возможность поработать с отдельным нейроном. Не слишком важно, что это за нейрон, и каким конкретным методом мы будем к нему подбираться. Это может быть нервная клетка одного из отделов мозга (рис. 19), до которой мы добрались, предварительно занаркотизировав (подобно операционному наркозу в хирургических клиниках) животное, закрепив его голову в специальном станке (стереотаксисе), сняв участок скальпа, проведя трепанацию черепа (проще говоря, просверлив череп в строго определённом месте) и с по мощью микроманипулятора введя микроэлектрод в чётко известную структуру мозга (вводить мы его будем по координатной сетке трёхмерного атласа — такие атласы есть практически для всех лабораторных животных).
Это может быть один из нейронов тончайшего переживающего среза одной из мозговых структур (переживающими такие срезы — слайсы = slices — называют не за особую эмоциональность, а за то, что в искусственно созданной среде эти мозговые срезы надолго переживают своего хозяина — крыску, хомячка, морскую свинку и т. д.).
Это может быть одна из клеток культуры нервной ткани: для тех, кто наслышан про пресловутое клонирование, возможность выращивания в чашке Петри целой популяции одинаковых клеток из одной первоначально взятой не кажется фантастикой.
Наконец, это может быть периферический отросток (лучше —аксон) нервной клетки какого-нибудь животного; первые эксперименты, подобные обсуждаемому нами, так и делались: в 40—50-е годы ХХ века великолепная группа физиологов под руководством Алана Ходжкина смогла понять механизмы возникновения биопотенциалов благодаря работе на гигантском аксоне кальмара (сами-то кальмары не были гигантскими, просто для эффективной работы реактивного двигателя этого животного — колокола, из-под которого «выстреливает» вода, — нужна очень высокая скорость распространения нервных импульсов вдоль колокола, а чем больше диаметр волокна, тем быстрее по нему бегут импульсы, поэтому у знакомых всем по салатам кальмаров аксоны мотонейронов можно увидеть невооружённым глазом).
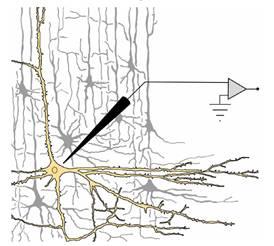
Рис. 19. Вполне правдоподобный рисунок, воспроизводящий принцип микроэлектродного отведения потенциалов от одиночного нейрона.
Итак, наша первая насущная задача — выяснить, есть ли на мембране аксона, находящегося в состоянии покоя (во время межимпульсного интервала), какой-либо электрический потенциал, и если есть, то какой. Используем уже упоминавшийся микроэлектрод. Подводим его кончик непосредственно к мембране аксона. Второй электрод — здесь вполне подойдёт и макроэлектрод — помещаем где-то поблизости, не очень заботясь о точности его расположения: так как нам нужно мерить разность потенциалов, обязательно нужны два электрода — активный (микроэлектрод) и индифферентный (можно макро-). Подсоединяем оба электрода к измерительной аппаратуре, включаем и… на нашем мониторе мы видим тоскливую прямую: разность потенциалов (давайте говорить проще — потенциал) равна нулю, то есть её просто нет при расположении обоих электродов снаружи от мембраны (рис. 20).
Теперь начинаем осторожно, с помощью микроманипулятора, опускать микроэлектрод. В какой-то момент его кончик проткнёт мембрану и войдёт внутрь нервной клетки (не надо пугаться: ведь мембрана — это жидкий бислой липидов, так что с нейроном ничего не случится; вспомните: «нож сквозь масло»). И именно в этот момент мы увидим на экране резкий скачок уровня потенциала — до 60—70 мВ, причём, судя по показателям, внутренняя поверхность мембраны окажется заряженной отрицательно по отношению к наружной поверхности.
|
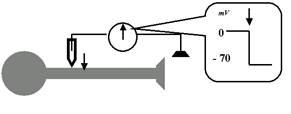
Рис. 20. Измерения мембранного потенциала нейрона в состоянии покоя, то есть во время межимпульсного интервала. Пока микроэлектрод находится на поверхности мембраны, регистрируется отсутствие значимой разности потенциалов между ним и макроэлектородом, который может находиться достаточно далеко от данного нейрона. Как только с помощью микроманипулятора мы опускаем кончик микроэлектрода и «входим» под мембрану (этот момент обозначен стрелкой), наша измерительная аппаратура улавливает резкий скачок потенциала: внутренняя поверхность мембраны оказывается значительно (на десятки милливольт) более электроотрицательной, чем наружная. Это и есть потенциал покоя мембраны (ПП).
Итак, установлен первый вполне конкретный научный факт: во время межимпульсной паузы, в состоянии релаксации, покоя, внутренняя поверхность мембраны нейрона заряжена отрицательно относительно наружной, и уровень этого потенциала колеблется (в зависимости от условий конкретного опыта) около 60—70 мВ. Поздравляю: мы зарегистрировали ПП — потенциал покоя мембраны!
На конкретные значения ПП не стоит обращать особого внимания: в зависимости от того, какую возбудимую клетку мы обследуем, у какого животного, в каких условиях, значения могут несколько меняться. Здесь важно другое: устойчивый, всегда воспроизводимый факт наличия отрицательного электрического заряда на внутренней поверхности мембраны. Откуда же он взялся? Для ответа на этот вопрос вспомним недавний разговор про мембрану и её свойства. И снова речь пойдёт об особенностях химического градиента ионов по разные стороны мембраны и об ионных каналах.
В своих, ставших сегодня уже классическими экспериментах сотрудники группы Ходжкина обнаружили, что в состоянии покоя на нейрональной мембране открыты каналы одного-единственного вида:
K+-поры. Давайте ещё раз вспомним, что означает такое название: во-первых, это поры, стало быть, ворота у них отсутствуют, и они открыты всегда; во-вторых, это K+-каналы, то есть они пропускают почти исключительно ионы K+ по градиенту концентрации. А как направлен химический градиент K+? Изнутри наружу клетки. То есть ионы K+ будут выходить через эти каналы наружу (рис. 21). А теперь самый ключевой вопрос: до каких пор будет происходить этот выход K+?
Ответ, казалось бы, напрашивается сам собой: до тех пор, пока концентрация этих ионов по разные стороны мембраны не станет одинаковой. И этот ответ был бы верным (ведь он вполне в русле термодинамических законов), если бы не одно существенное обстоятельство: мы имеем дело не с простыми электрически нейтральными веществами, а с ионами. А в этом случае устранение одной «несправедливости» (неравенства концентраций) неизбежно приведёт к возникновению другой «несправедливости» — неравенству электрических зарядов по разные стороны мембраны. Ведь с каждым выходящим из клетки по градиенту концентрации ионом K+ клетка одновременно теряет и положительные заряды, которые перетекают на наружную поверхность мембраны
(рис. 22).
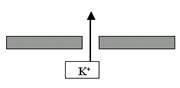
Рис. 21. В состоянии покоя ионы K+ через поры выходят из клетки по градиенту концентрации.
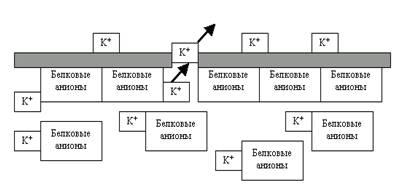
Рис. 22. Выход ионов K+ из клетки по градиенту концентрации приводит к созданию электрического градиента на мембране: внутри клетки накапливаются «осиротевшие» белковые анионы (следовательно, отрицательные заряды), а снаружи катионы K+, то есть положительные заряды.
То есть в клетке формируется дефицит плюсов (зато избыток минусов — не забывайте, например, про белковые анионы, которым через каналы не пройти при всём желании), а вокруг неё — избыток тех же самых плюсов. Стало быть, возникает электрическое неравновесие, электрический градиент на мембране
Вернёмся к ключевому вопросу: до каких же пор возможен выход ионов K+ из клетки? Если до сих пор не догадались, попробуем вспомнить младшешкольную физику. Мы с Вами стараемся понять механизмы, формирующие ПП мембраны. При каких условиях некое вполне материальное тело находится в состоянии покоя (или равномерного прямолинейного движения — что, по существу, одно и то же)?
Представьте себе, что на Вашем письменном столе лежит книжка. Почему она не падает на пол и не взлетает к потолку? Надеюсь, Вы вспомнили: потому что силы, действующие на эту книжку, равны и направлены в противоположные стороны (рис. 23). Сила тяжести тянет эту книжку вниз, а сила сопротивления (противодействия) опоры (стола) столь же решительно препятствует этому.
|
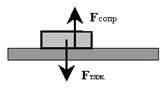
Какое это отношение имеет к ионным процессам на мембране нейрона? Самое прямое! Мы с Вами стараемся понять механизмы, формирующие потенциал покоя (ПП) мембраны. Мы (вслед за группой Ходжкина) выяснили, что в покое на мембране формируются две силы: химический градиент ионов K+ (провоцирующий выход этих ионов из клетки через поры) и встречный электрический градиент (то есть потенциал), связанный с потерей клеткой положительных зарядов. Тогда становится понятным, что условием равновесного («спокойного») состояния мембраны является равновесие этих двух диаметрально противоположно направленных сил (рис. 24).
Необходимо подчеркнуть два момента: во-первых, когда мы говорим о выходе ионов калия из клетки и «выстраивании» их по наружной поверхности мембраны, речь идёт исключительно о тончайшем примембранном слое, чуть дальше в межклеточном пространстве концентрация K+ по-прежнему будет значительно ниже, чем внутри клетки. Во-вторых, описанное нами на качественном уровне объяснение механизма формирования ПП может быть представлено гораздо строже, если мы воспользуемся так называемым уравнением Нернста.
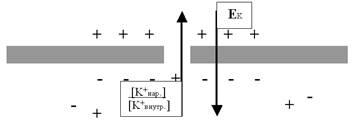
Рис. 24. Потенциал покоя (ПП) или равновесный калиевый потенциал (EK), существующий на мембране возбудимой клетки в период межимпульсного интервала, уравновешивает химический градиент по калию ([K+нар] / [K+внутр]).
Вопреки прозрачным намёкам некоторых учебников немецкий учёный Нернст не был физиологом (тем более — нейрофизиологом, ведь в XIX веке эта наука только зарождалась); он был выдающимся физхимиком. И своё уравнение диффузии ионов через полупроницаемые мембраны он вывел как общую закономерность, а вовсе не для описания транспорта K+ через нейрональную мембрану. Но знаменитым стало именно нейробиологическое приложение его закона. Итак, что же это за формула?
EK = (R × T / F × Z) × ln ([K+нар] / [K+внутр]),
где EK — электрический потенциал мембраны по K+,
R — газовая постоянная,
T — абсолютная температура,
F — число Фарадея,
Z — валентность иона K+,
[K+нар] / [K+внутр] — градиент концентрации ионов K+ снаружи и внутри клетки.
Учитывая, что эта книга написана в том числе и для убеждённых гуманитариев, постараемся помочь им преодолеть священный ужас перед любыми формулами. Вглядитесь повнимательней: первые четыре переменные в данном уравнении — это вполне конкретные численные значения, которые легко можно найти в любом физическом или химическом справочнике. Логарифмирование — не более чем математический приём.
Что же тогда остаётся? То, что равновесный калиевый электрический потенциал на мембране нейрона при стандартных условиях зависит от соотношения концентрации ионов K+ снаружи мембраны к их концентрации внутри:
EK » – ([K+нар] / [K+внутр]).
Значком » мы рискнули обозначить некое принципиальное соответствие правой и левой частей выражения, потому что знак равенства ставить теперь мы уже не имеем права; а минус перед правой частью выражения неизбежно должен был появиться при уходе от логарифмирования (вспомните: при логарифмировании дроби, в которой числитель меньше знаменателя, получается отрицательное число). Таким образом, при анализе уравнения Нернста смысловое содержание нашего качественного рассуждения вполне подтвердилось. Хочется ещё раз подчеркнуть, что формализация электрохимического сопряжения приложима ко всем вариантам ионных токов через мембраны. Не случайно на базе полного уравнения Нернста (в него входят ионные градиенты не только для калия, но и для натрия и хлора) Гольдманом, а чуть позднее Ходжкиным, Хаксли и Катцем были прописаны уравнения «постоянного поля» нейрона, ставшие сегодня одной из основ математического моделирования электрических процессов на мембране нейронов (заметим в скобках, что к передаче информации подобного рода модели имеют самое прямое, но — увы! — пока ещё весьма далёкое отношение).
Если у Вас сложилось впечатление, что с причинами возникновения ПП теперь всё ясно, вынужден Вас огорчить. Оказывается, если действительно подставить в уравнение Нернста все необходимые численные значения, то вычисленный уровень ПП окажется не совсем таким, как экспериментально измеренный.
Несложные вычисления приведут к значениям EK » –85 мВ, а реальные измерения дают, как Вы помните, цифры около –60—70 мВ. Почему такое расхождение, нет ли ошибки в самой гипотезе?
И да, и нет. Нет, потому что бесчисленные измерения абсолютно однозначно показывают, что именно калиевый ток через мембрану является главным, доминирующим фактором формирования ПП. Да, потому что мы имеем дело с живой системой, в которой не может быть ничего абсолютного. Сегодня хорошо известно, что в покое мембрана нейрона пропускает по градиентам концентраций не только ионы калия, но и натрий, хлор и т. д. Другое дело, что их суммарный вклад в конечный уровень ПП невелик, хотя и, как Вы видите, заметен.
4.2. Потенциал действия (ПД), или нервный импульс (спайк)
Теперь, когда мы выяснили, что в покое мембрана нейрона уже заряжена (поляризована), пришла пора обратиться непосредственно к потенциалу действия (ПД). Представьте, что у регистрируемого нами нейрона закончился межимпульсный интервал и мы дождались импульса. Или, чтобы не ждать милостей от нейрона, мы через так называемые стимулирующие электроды (к замечательному прибору электростимулятору мы ещё вернёмся попозже) нанесли на поверхность этого нейрона слабенький (всего-то несколько милливольт) стимул. И вспомните
рис. 17. На нём отдельные импульсы выглядят как вертикальные чёрточки, что неудивительно: длительность ПД составляет одну-две миллисекунды (мс) — интервал времени, уловить который без аппаратуры человеку не дано. Да и на слух, если нашу регистрирующую аппаратуру дополнить динамиками, импульсная активность нейрона звучит как беспорядочная автоматная стрельба на бейрутских улицах.
Что же делать, если изучаемый нами объект так миниатюрен и по амплитуде (десятки милливольт), и по длительности (миллисекунды)? Ответ, вообще говоря, хорошо известен: чтобы увидеть инфузорию-туфельку, надо взять микроскоп. Нам даже и микроскопа не надо, чтобы увеличить наш ПД. Надо просто растянуть на экране компьютера ось времени (X) и ось амплитуды ПД (Y), и мы увидим нервный импульс во всех деталях (рис. 25).
|
|
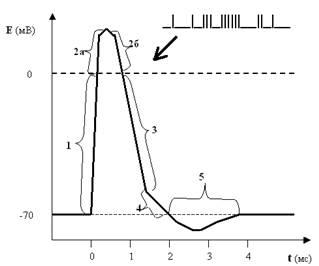
Рис. 25. Потенциал действия (ПД) мембраны нейрона или нервный импульс. Цифрами обозначены фазы ПД: 1 — деполяризация; 2а и 2б — реверсия или овершут; 3 — реполяризация; 4 — следовая деполяризация; 5 — следовая гиперполяризация.
Оказывается, ПД имеет достаточно сложную форму, и, двигаясь по оси времени, мы можем разложить его на 5 фаз:
фаза деполяризации — от исходного уровня ПП до 0 (то есть мембрана в это мгновение электронейтральна);
реверсия ПД или овершут — уровень ПД выше 0 (то есть в этот момент мембрана внутри становится заряженной положительно, а не отрицательно, как было в покое);
фаза реполяризации — уровень мембранного потенциала демонстрирует явственное стремление вернуться к исходному уровню ПП;
следовая деполяризация — спад графика ПД становится менее крутым, то есть к исходному уровню ПП потенциал мембраны возвращается несколько медленнее, чем во время реполяризации;
следовая гиперполяризация — в этот короткий период времени мембрана поляризована даже больше, чем в состоянии покоя.
Не стоит сразу пугаться этих новых терминов: они вполне доступны пониманию и весьма информативны. Мы теперь знаем, что в покое мембрана заряжена, или поляризована. Это и есть коренное слово. А дальше — работа с приставками: де- — приставка негативная, отрицательная; действительно, и в 1-й, и в 4-й фазах мембрана менее поляризована, чем в покое; ре- — возвратная приставка (ретро-), соответственно, в 3-й фазе мы видим возвращение ПД (вектор) к исходному уровню. Гипер- — слишком, чересчур; действительно, в 5-й фазе мембрана поляризована слишком сильно, больше, чем в покое. Наконец, обозначения 2-й фазы выходят за рамки этого правила, просто и реверсия, и овершут — это переворачивание чего-то, в нашем случае — мембранного потенциала.
Но назвать ещё не значит объяснить. Давайте разбираться, почему мембрана нейрона в ответ на электрический стимул так прихотливо меняет свой заряд. И снова пойдём по стопам группы Ходжкина.
Начнём с фазы деполяризации. Почему в ответ на внешний стимул поляризация мембраны начинает очень быстро уменьшаться? Оказывается, в это мгновение на мембране начинают активироваться потенциалзависимые натриевые каналы (рис. 26).
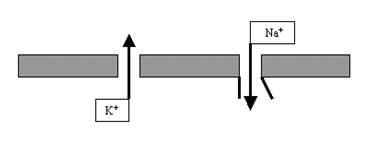
Рис. 26. В ответ на электрический стимул на мембране нейрона наряду с постоянно открытыми K+-порами открываются потенциалзависимые Na+-каналы, обеспечивающие входящий натриевый ток.
В названии этих каналов — 2 ключевых слова: во-первых, они селективны по Na+; а во-вторых, они активируются только при вполне определённых изменениях электрического потенциала мембраны.
И вот этот второй момент заставляет нас вернуться к понятиям «стимул» и «электростимулятор». Конечно, можно во время исследования спокойно ждать, когда на нейроне возникнет очередной нервный импульс, тем более что всегда молчащих нейронов по определению не бывает. Но гораздо удобнее, если мы будем точно знать, когда возникнет ПД, а для этого проще всего самим спровоцировать его возникновение.
это можно сделать, нанеся на нейрон адекватный (соответствующий его свойствам) стимул. Раз речь идёт о потенциалзависимых каналах мембраны, то стимул должен быть электрическим. И сформировать этот стимул мы можем с помощью лабораторного электростимулятора
(рис. 27).
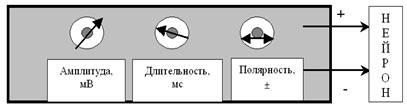
Рис. 27. Примитивный лабораторный электростимулятор позволяет регулировать амплитуду стимула (от 0 до нескольких десятков тысяч милливольт), его длительность (от долей миллисекунды до десятков секунд) и полярность (+ или –). Стимул представляет собой прямоугольный (П-образный) импульс постоянного тока.
Хорошо известно, что электрические процессы в наших нейронах нужно имитировать не привычным для нас переменным током, а импульсами постоянного тока. Уже совсем скоро (при рассмотрении синапса) мы с Вами поймём, с чем это связано. Именно для имитации реально происходящих в нейронах процессов и были сконструированы первые электростимуляторы данного типа.
Итак, мы возвращаемся к ПД. Что же происходит в нейроне сразу в ответ на стимул?
Если мы подадим на мембрану слабый (всего несколько милливольт) прямоугольный катодический (то есть идущий от отрицательного полюса нашего стимулятора) стимул, возникнет начальная деполяризация мембраны. Этого незначительного сдвига мембранного потенциала в сторону 0 достаточно, чтобы активировалась первая порция потенциалзависимых Na+-каналов.
Естественно, через них с существенно большей вероятностью, чем в покое, возникнет входящий Na+-ток. Катионы Na+, входя в клетку по градиенту концентрации, уменьшают электроотрицательность внутренней поверхности мембраны, то есть деполяризуют её ещё больше (рис. 28).
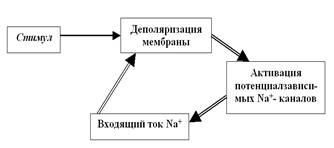
Рис. 28. Цикл Ходжкина, обеспечивающий восходящую фазу (фазу деполяризации) ПД. Обратите внимание: стимул нужен только на начальном этапе — для запуска цикла Ходжкина, а дальше процесс развивается самопроизвольно, по механизму положительной обратной связи. В результате возникает лавинообразно нарастающий входящий ток катионов Na+.
Круг замкнулся, и теперь все будет повторяться и повторяться.
Впервые этот механизм был описан всё той же группой Ходжкина и в мировой литературе получил наименование «цикл Ходжкина». По существу, это классический пример системы с положительной обратной связью. Здесь каждый предыдущий шаг подстёгивает следующий за ним, усиливая эффект. В биологических системах такого рода механизмы встречаются не слишком часто (в тех случаях, когда или требуется усилить эффект, или нужно синхронизировать изначально независимые процессы — например, при брачном поведении у животных).
В технике системы с положительной обратной связью мы видим сплошь и рядом: это один из самых распространённых видов усилителей.
Цикл Ходжкина поучителен, по крайней мере, по двум причинам.
Во-первых, мы видим, как остроумно природа решила проблему быстрого усиления входящего тока Na+ и, соответственно, деполяризации мембраны. Не случайно во многих книжках процесс нарастания входящего натриевого тока называют лавинообразным.
Во-вторых, становится более понятной роль начального стимула в запуске ПД. Это, по существу, аналог стартёра в современном автомобиле: маленький слабый электромоторчик, работающий от аккумулятора, может раскрутить тяжёлый на подъём двигатель внутреннего сгорания («завести» его), а дальше он будет работать вполне самостоятельно («самопроизвольно», как сказали бы мы).
На стартёре, в принципе, тоже можно проехать несколько метров, но лучше этого не делать из гуманистических соображений. И на мембране нейрона стимул тоже нужен только «на старте» ПД, а дальше процесс поддерживает себя сам. Очень важный вопрос «а всякий ли стимул запустит ПД?» мы проанализируем немножко попозже.
И ещё один вопрос, связанный с восходящей фазой ПД. Если цикл Ходжкина — самоусиливающийся процесс, то почему он не развивается бесконечно, что служит ограничителем входящего тока Na+? Ответов несколько. Прежде всего это уже обсуждавшееся нами уравнение Нернста, описывающее взаимосвязь электрического потенциала полупроницаемой мембраны и концентрационных градиентов. Естественно, что изменение градиента (одной из действующих сил) неизбежно ведёт и к изменениям потенциала (второй силы), и далее по циклу.
Число потенциалзависимых каналов на данном участке мембраны хоть и велико, но не бесконечно. А если учесть, что только что активировавшийся канал не может сразу же открыться вторично (о причинах этого мы поговорим чуть позже), становится понятным наличие ограничений на циклические процессы на мембране. Есть и ещё несколько менее значимых факторов, обсуждение которых мы вынесем за скобки.
Итак, вопрос о механизме деполяризации более или менее прояснился. Но ПД развивается дальше, и после пика реверсии, когда внутренняя поверхность мембраны становится положительно заряженной, наступает фаза реполяризации. Какие мембранные механизмы обеспечивают её развитие? Мы должны назвать, как минимум, три фактора:
в результате инактивационных процессов закрываются Na+-каналы и прекращается (точнее, минимизируется) входящий натриевый ток;
продолжается выходящий ток K+ через поры;
развивается дополнительный выходящий ток K+ через потенциалзависимые калиевые каналы (рис. 29).
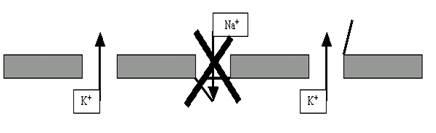
Рис. 29. Фаза реполяризации ПД обусловлена, как минимум, тремя факторами: а) прекращением входящего тока Na+; б) продолжением выхода K+ через поры;в) дополнительным выходящим током K+ через потенциалзависимые калиевые каналы.
Думается, Вы почувствовали, что если два первых фактора вполне очевидны, то третий требует дополнительных разъяснений. В самом деле, что же это за «дополнительные» потенциалзависимые K+-каналы, которые активируются так своевременно? И этому открытию уже полвека. Действительно, мы же нигде не оговаривали, что эксклюзивным правом открываться в ответ на изменения потенциала мембраны обладают только Na+-каналы. Белковые субъединицы, образующие K+-каналы, тоже могут быть чувствительными к этим изменениям. Тогда, может быть, для их активации требуются какие-то другие, отличающиеся от необходимых для Na+-каналов параметры изменений потенциала мембраны? Да нет, диапазон примерно тот же. А раз так, значит, эти K+-каналы активируются в ответ на тот же начальный стимул, что и Na+? Ответ пугающе прост: да!
Вдумайтесь в этот ответ! Если каналы для двух катионов (натрия и калия) открываются в ответ на сходные изменения потенциала мембраны, то есть на один и тот же стимул, а градиенты концентраций этих катионов направлены навстречу друг другу, то должен возникнуть встречный ток двух этих ионов, и об изменениях потенциала на мембране можно вообще забыть. Но эти изменения есть, иначе информация Вашим мозгом не могла бы обрабатываться, и Вы не могли бы читать эти строки. Где же нестыковка? Какие факторы не были учтены?
Чтобы разобраться, нам придётся ввести одно из ключевых понятий мембранологии: проницаемость мембраны для ионов (g). Этот термин означает, сколько данных ионов (Na+, K+, Cl– и т.д.) пропустит единица площади данной мембраны (например, 1 квадратный нанометр) в единицу времени (например, в 1 миллисекунду). Когда мы упоминали уравнения Ходжкина — Хаксли, Катца и др., вскользь было сказано, что они являются развитием идеи Нернста; так вот, одним из элементов этого развития как раз и было введение в уравнения показателя проницаемости мембраны для данных конкретных ионов.
Нам этот показатель сейчас нужен для того, чтобы разобраться в загадке «встречных перевозок» катионов через мембрану. Оказывается, хотя процесс активации ионных каналов Na+ и K+ и начинается одновременно (в ответ на стимул), скорость нарастания этой активации, и соответственно проницаемости, существенно различна для ионов Na+ и K+ (рис. 30).
Скорость нарастания (а затем и спада) натриевой проницаемости намного выше, чем калиевой. Поэтому массированный вброс Na+ в первые мгновения ПД существенно опережает медленно нарастающий выход K+, даже несмотря на то, что калиевая проницаемость мембраны изначально больше (за счёт постоянно открытых калиевых пор). Соответственно, входящий и выходящий катионные токи разведены по времени, и вслед за деполяризацией развивается реполяризация мембраны.
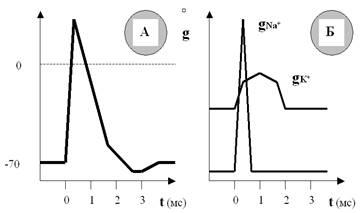
Рис. 30. В одном временном масштабе показаны ПД (А) и изменения проницаемости мембраны (Б) для ионов Na+ и K+. Хорошо видно, что проницаемость для Na+ резко возрастает в ответ на стимул и так же быстро падает почти до нуля. Проницаемость для K+ начинает возрастать одновременно с натриевой, но увеличивается и спадает гораздо медленнее. Кроме того, проницаемость мембраны для K+ уже изначально гораздо выше, чем для Na+, так как калиевые поры остаются открытыми всё время.
По существу, с завершением фазы реполяризации завершаются и главные информационно значимые процессы на мембране. Далее, как Вы помните, развиваются следовые процессы, характер которых может различаться в разных возбудимых клетках (вплоть до перемены местами следовой деполяризации и гиперполяризации), и которые, видимо, «не считываются» нашим белковым компьютером напрямую. Но это не значит, что они не влияют на мозговые коды и соответственно на обработку информации. Сегодня существуют вполне биологоправдоподобные модели нейронных сетей, в которых главным изменяемым параметром является период следовой гиперполяризации. Эти виртуальные «мозги» вполне успешно справляются с весьма сложными задачами, что подтверждает небезразличность для информационных процессов следовых («остаточных», как может казаться) изменений поляризации.
Однако эти тонкости выходят за пределы нашей книжки. Нам хотелось бы показать на примере следовых процессов значимость ещё одного транспортного механизма мембраны. Речь пойдёт об ионных насосах. Мы с Вами уже рассматривали общие принципы их работы, так что теперь можем обсудить только самое главное.
Посмотрите ещё раз на рисунок ПД (рис. 31). Совершенно ясно, что к моменту завершения процесса реполяризации соотношения ионных градиентов по обе стороны мембраны явно не соответствуют «нормативным параметрам», характерным для ПП.
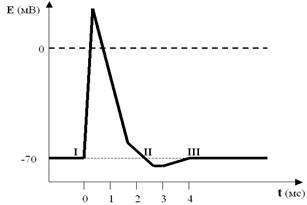
Рис. 31. И снова ПД со всеми его фазами. Обратите внимание на точки I, II и III. Как видите, они лежат на одной прямой, то есть уровень мембранного потенциала в них один и тот же (как мы договорились, около –70 мВ). А что Вы скажете об ионных градиентах по обе стороны мембраны? Ведь совершенно очевидно, что в I и III точках они совпадают или почти совпадают. А во II точке?
Тем не менее после окончания следовых процессов мембрана
вполне готова к генерации нового импульса (строго говоря, она готова к этому и несколько раньше, но об этом мы ещё поговорим), потому что к этому моменту уровни катионных градиентов успевают вернуться к исходным значениям.
Единственным механизмом, способным так быстро восстанавливать ионные градиенты, является ионный насос. В разбираемом нами случае это Na+-K+-ионообменник, или Na+-K+-помпа. Вы, конечно, помните, что такой насос качает ионы против градиента концентрации, затрачивая на это энергию АТФ.
Вопреки декларациям многих современных учебников я утверждаю (основываясь на экспериментальных данных, естественно), что эти насосы работают непрерывно, постоянно поддерживая неравновесие концентраций ионов по разные стороны мембраны. Как Вы уже поняли, во время ПД такое неравновесие нарушается особенно сильно. Замечательно, что натрий-калиевый насос в это время резко увеличивает свою активность, чему способствует его особое свойство — электрогенность (это значит, что он активируется при изменении мембранного потенциала, то есть именно во время ПД). А дальше — своеобразный эффект маскировки: пока потенциалзависимые каналы открыты и пропускают ионы по их концентрационным градиентам, интенсивная работа насосов относительно незаметна и обнаруживается только при достаточно тонкой постановке экспериментов, когда же процессы деполяризации и реполяризации остались позади — активный ионный транспорт с помощью насосов проявляется во всей красе. Таким образом, именно во время следовых процессов мы наиболее явно обнаруживаем присутствие на мембране энергозависимых ионообменников — насосов (рис. 32).
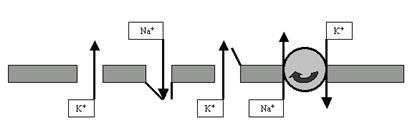
Рис. 32. Относительно полная схема мембраны нейрона, описывающая базовые процессы, которые обеспечивают формирование ПП и ПД: K+-поры (открыты всегда и участвуют как в ПП, так и в ПД), Na+-потенциалзависимые каналы (главный фактор фазы деполяризации ПД), K+-потенциалзависимые каналы (наряду с порами обеспечивают фазу реполяризации ПД), Na+-K+-помпа (восстанавливает и поддерживает катионные градиенты на мембране).
4.3. Свойства потенциала действия (ПД)
Хочется надеяться, что мы с Вами разобрались в основных процессах, формирующих элементы «языка мозга» — нервные импульсы.
Но нужно шагать дальше, ведь импульсы способны распространяться только по мембране одного нейрона. Для того чтобы закодированная их последовательностью информация могла быть передана следующему нейрону, требуется преодолеть щелевой контакт между возбудимыми клетками — синапс. А в синапсе принципы передачи и переработки информации будут не совсем такими, как на обычной электрогенной мембране (например, мембране аксона).
Парадокс заключается в том, что мы не сможем понять принципы работы синапса, если не разберём ещё один важный момент в принципах работы аксональной мембраны — так называемые свойства потенциала действия.
Принято выделять 5 базовых свойств ПД.
1. ПД подчиняется закону «всё или ничего» (рис. 33).
Вообще говоря, приведённая схема так очевидна, что не требует дополнительных комментариев. Но сам по себе закон «всё или ничего» настолько интересен, что мы просто обязаны на нём остановиться и поговорить поподробнее. Ведь речь-то идёт об одном из базовых понятий и физиологии, и психологии: о порогах. Самое распространённое определение порога звучит весьма тривиально: порог — это то минимальное значение стимула, на которое живая система отвечает изменением своей активности. Принято различать абсолютные (верхний и нижний) и дифференциальные пороги (или пороги различения стимулов) (рис. 34).
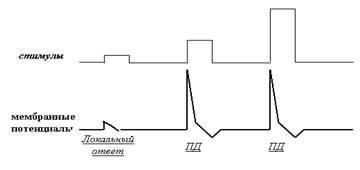
Рис. 33. Схема иллюстрирует закон «всё или ничего». Увеличивая силу наносимого от электростимулятора стимула, мы обнаруживаем, что при подпороговом значении стимула ПД не формируется, а развивается нераспространяющийся электротонический локальный ответ («ничего»). Если же мы перешагнули порог амплитуды стимула, разовьётся полноценный ПД, причём он будет одинаковым независимо от того, насколько нанесённый стимул сильнее порогового («всё»).
Если говорить о ПД, то закон «всё или ничего» как раз характеризует особенности реагирования электрогенной мембраны нейрона на стимулы, превышающие или не превышающие уровень нижнего абсолютного порога. А вот дифференциальные пороги и их особенности нервного импульса как раз никак не касаются! Именно поэтому наивные попытки некоторых авторов вкладывать в форму, длительность, амплитуду и другие характеристики ПД какой-то информационный смысл свидетельствуют о том, что эти авторы никогда не видели импульсную активность нейронов «живьём» и знают о ней сугубо понаслышке.
Давайте попробуем разобраться, почему же закон «всё или ничего» так императивен. Вспомните цикл Ходжкина. Для его запуска требуется преодолеть определённое пороговое значение деполяризации (в электрофизиологии его называют КУД — критический уровень деполяризации).
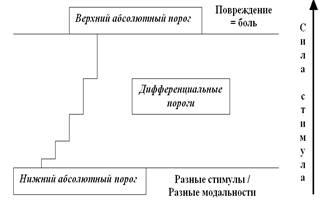
Рис. 34. Понятие порогов чрезвычайно важно и для психологов, и для физиологов. Нижний абсолютный порог характеризует минимальное значение силы стимула, при котором живая система (клетка или её часть, ткань, орган, организм и т. д.) начинает «чувствовать» стимул (и его специфические особенности). Запуск ПД — это как раз игра на уровне нижнего абсолютного порога. Дифференциальные пороги характеризуют возможность различения силы (интенсивности) стимулов; чем больше сила стимула, тем выше эти пороги (закон Вебера — Фехнера). После превышения максимально возможной для данной живой системы интенсивности стимула начинает развиваться повреждение системы и утрачиваются индивидуальные признаки стимула; на сенсорном уровне это ощущается как боль.
Этот уровень в некоторой степени индивидуален для каждого нейрона (разница иногда смешная — доли микровольта) и зависит исключительно от характеристик мембраны данной возбудимой клетки, а именно от количества (и, между прочим, качества) канальных белков. Давайте решим очень простую задачу: имеются два одинаковых по площади участка мембраны (1 квадратный микрометр, 1 квадратный метр — какая разница?), один весь буквально испещрён ионными каналами (пусть натриевыми), а на другом их ещё поискать придётся (рис. 35).
Какую мембрану легче возбудить?
Где нужен меньший начальный стимул?
Где, стало быть, будет ниже КУД?
Ответ-то простой: если на склоне горы лежат пять-шесть камней, потребуется сизифов труд, чтобы заставить их сымитировать хоть маленькую лавинку; если же весь склон в камнях — одного неосторожного движения (крика, слова) достаточно, чтобы сошла настоящая лавина (никогда так не делайте, а то будет, как с Бодровым-младшим!).
Стало быть, способность мембраны ответить потенциалом действия на пришедший к ней стимул определяется тем, насколько она возбудима в настоящий момент (очень важно! мы скоро вернёмся к этому), и хватит ли силы стимула, чтобы запустить на ней цикл Ходжкина. Но, оказывается, судьба ПД зависит не только от силы, но и от длительности сти-мула.
Рис. 35. Чем меньше плотность (количество на единицу площади) каналов на мембране, тем труднее эту мембрану возбудить: для мембраны Б потребуется значительно больший стимул, чем для мембраны А. Кстати, важным может оказаться не просто формальное количество каналов, а их способность активироваться: мы можем «отравить» мембрану каким-нибудь нейротропным препаратом (например, анестетиком типа ультракаина), и каналы-то на мембране останутся, а вот открыться в ответ на деполяризацию смогут далеко не все.
2. Существуют критические для ПД параметры длительности стимула?
Мы уже проводили аналогию между стимулом и стартёром автомобиля. Действительно, если аккумулятор сел, стартёру не хватает силы для запуска двигателя. Но если пытаться завести даже вполне исправную машину короткими поворотами ключа зажигания (как это часто делают новоиспечённые водители), толку тоже не будет: двигатель будет «глохнуть».
И здесь тоже прямое сходство с ПД: существует не только пороговое значение силы стимула, но и пороговое значение его длительности (рис. 36).
Причина та же: при слишком коротких стимулах не удаётся набрать «критическую массу» активированных каналов для запуска цикла Ходжкина. В реальной нервной системе, конечно же, отрабатывают оба эти параметра, и эту общую закономерность хорошо выражает так называемая «кривая силы — длительности» (рис. 37). Очень советую: постарайтесь с ней поработать — это хорошая возможность научиться читать гра-фики.


Рис. 36. Подпороговая длительность стимула так же, как и подпороговая сила, не провоцирует ПД, а вызывает только локальный ответ, который связан с тем, что в нашем теле все ткани являются хорошими проводниками электрического тока, а изоляторов, стало быть, просто нет. Поэтому при нанесении электрического стимула по мембране как простому физическому проводнику пойдёт ток, но «далеко не уйдёт», ведь вокруг-то тоже проводники (представьте себе оголённый провод, упавший в ванну с морской водой, — только экспериментировать не надо, а то весь район без света оставите!). Локальный — «locus=место»: где локальный ответ зародился, там (или почти там) и умрёт. Такие процессы называются электротоническими. В каждом ПД есть элемент локального ответа, но распространяются только потенциалы действия.
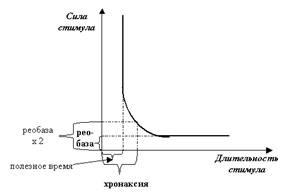
Рис. 37. Классическая «кривая силы-длительности» графически выражает сразу оба свойства ПД. Обратите внимание на параллельные осям участки графика: параллельность оси X демонстрирует закон «всё или ничего» (стимул, меньший по силе порогового значения — реобазы, не вызовет ПД); параллельность участка графика оси Y показывает, что и для длительности стимула тоже существует пороговое значение, короче которого наносить стимул бесполезно (отсюда — «полезное время»). Эти показатели оказались не очень удобными, потому что характеризовали только уровни нижних абсолютных порогов. А ведь самой интересной является область перехода от одной параллельности к другой, когда и сила и длительность стимула закономерно дополняют друг друга. Для регистрации характеристик этой области было введено понятие хронаксии, которое отражает минимальную длительность стимула, вызывающего ПД при силе стимула, равной удвоенной реобазе.
3. Судьба ПД определяется также полярностью стимула (законы Пфлюгера)
Ещё одним принципиально важным свойством ПД является его зависимость от полярности стимула. Вспомните наш электростимулятор (см. рис. 27): у него 3 главные ручки, позволяющие менять как раз силу, длительности и полярность стимула. То, что направление стимулирующего постоянного тока решительным образом влияет на возбудимость мембраны, впервые было показано ещё в позапрошлом веке замечательным немецким физиологом Пфлюгером в удивительно изящных для того времени экспериментах. Сформулированные Пфлюгером законы действия постоянного тока на возбудимые клетки и ткани звучат, на первый взгляд, довольно сложно даже в осовремененном вольном переводе: «При кратковременном действии постоянного тока на нервные клетки катод повышает возбудимость и может вызвать ПД, а анод снижает возбудимость и препятствует возникновению ПД». На самом деле, объяснение этих закономерностей достаточно примитивно и требует воспоминаний об уроках физики 5—6-го класса (рис. 38).
Рис. 38. Законы Пфлюгера объясняются достаточно просто! В покое мембрана поляризована: внутри — минус, снаружи — плюс. Если мы внезапно, рывком (щёлкнули выключателем, нажали кнопку, etc) добавили к наружным плюсам катодные минусы, уровень поляризации резко уменьшится — то есть мембрана деполяризуется (дальше см. цикл Ходжкина). Если же к уже имеющимся наружным плюсам прибавить ещё и плюсы от анода, поляризация усилится, то есть возникнет гиперполяризация — состояние пониженной возбудимости мембраны хотя бы потому, что для запуска цикла Ходжкина придётся теперь преодолевать значительно больший энергетический порог, чем при нормальном уровне ПП. Интересно, что при выключении электростимулятора снятие анодного тока может (хотя и с меньшей вероятностью) привести к возникновению ПД. Механизм проверяется очень простым опытом: растяните пружину и отпустите. Если будет больно, сами виноваты — думать надо!
Действительно, в этих эффектах постоянного тока очень мало биологического; практически обе закономерности проявляются на сугубо физическом уровне. И это очень хороший пример того, как физические (или химические) механизмы выстраивают логику сугубо биологических процессов. Не надо только увлекаться тем, что в философии называется редукционизмом: зачастую переход на более высокий уровень организации материи требует и перехода на иной уровень понимания процессов, обеспечивающих эту организацию, и сумма многих простых законов никак не складывается в один сложный закон (увы, физики и химики не всегда это понимают).
Нужно коснуться ещё двух нюансов.
Во-первых, если Вы внимательно читали предыдущие страницы, Вы, надеюсь, поняли, что для успешного запуска ПД на мембране требуется соблюдение трёх базовых условий:
а) стимул должен быть надпороговой силы;
б) стимул должен иметь надпороговую длительность;
в) стимул должен быть катодическим.
Эти сведения нам очень пригодятся для анализа механизмов синаптической передачи.
Во-вторых, говоря о действии постоянного тока на мембрану нейрона, мы неслучайно подчёркивали кратковременность действия катода или анода. Дело в том, что при длительном действии тех же электрических полюсов на нейрон обнаруживаются иные, «непфлюгеровские» закономерности. Впервые это сумел увидеть наш замечательный соотечественник, представитель знаменитой в своё время уральской физиологической школы Бронислав Фортунатович Вериго.
Вообще, вопреки распространённому (и упорно распространяемому в последние годы) мнению, российская физиологическая школа долгое время была (увы!) не менее уважаемой в научной среде, чем, например, химическая или физическая. Она дала миру такие великие имена, как Сеченов, Самойлов, Введенский, Вериго, Ухтомский, Павлов, Анохин, Бериташвили, Парин, Орбели, Черниговский, Костюк. Заглянув в учебник любой цивилизованной страны, Вы увидите там и «сеченовское торможение», и «доминанту Ухтомского», и «лёгочные рефлексы Парина», и «павловскую регуляцию пищеварения», и «парабиоз Введенского», и «катодическую депрессию Вериго», и «функциональные системы Анохина».
Так вот, именно Вериго в начале ХХ века показал, что если катодический ток будет действовать на возбудимую клетку десятки миллисекунд и более, вместо возбуждения разовьётся глубокое торможение (депрессия), и способность генерировать ПД может быть утрачена.
В то же время, он обнаружил и противоположный эффект — анодическую экзальтацию (правда, этот феномен довольно трудно воспроизводим и до сих пор вызывает дискуссии). Что же это за «вывернутые» закономерности? Оказывается, при долгом воздействии катода постепенно нарастает КУД. Мы-то с Вами теперь знаем, что критический уровень деполяризации зависит от свойств мембранных канальных белков, а вот первопроходцу, да ещё почти столетие назад, до этого надо было додуматься! Действительно, только сравнительно недавно, в последней трети ХХ века сложными современными методами удалось установить, что длительная деполяризация мембраны вызывает устойчивые нарушения проводящих свойств ионных каналов, что ведёт к нарастающему угнетению возбудимости. Да и вообще, возбудимость мембраны — это довольно лабильная характеристика. И рассмотрим мы это, в частности, на примере 4-го свойства ПД.
4. Потенциалы действия никогда не суммируются на мембране из-за наличия у неё свойства рефрактерности
Придётся нам с Вами представить себе ещё один эксперимент. Для этого нашему электростимулятору придётся приделать ещё одну кнопку (и электронный блок соответственно), которая позволит подавать на нейрон не одиночные стимулы, а два подряд. Причём очень важно, чтобы мы могли постепенно увеличивать временной интервал между первым и вторым стимулами. Казалось бы, ну и что? В ответ на каждый стимул должен возникать свой ПД. А если интервал будет не 1—2 мс, а сотые или тысячные доли миллисекунды? Ни в одной, даже самой малограмотной (намёк на современные учебники Вы поняли) книжке Вы не увидите рисунков, на которых нервные импульсы слились бы в одно пятно. Всегда есть дискретность! Почему? Давайте смотреть (рис. 39).
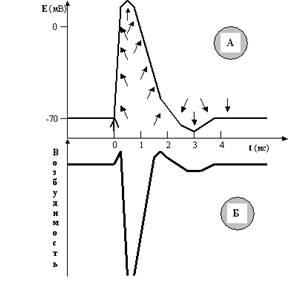
Рис. 39. Динамика возбудимости (способности генерировать ПД) мембраны нейрона (Б) при возбуждении (в процессе развития ПД) (А). Обратите внимание, что вслед за кратковременным небольшим повышением возбудимости (на начальном этапе деполяризации) наступает глубокий спад возбудимости (состояние рефрактерности), продолжающийся вплоть до завершения реполяризации. И только во время следовых процессов возбудимость возвращается к исходному уровню и колеблется около него.
На рисунке — друг под другом два графика. Ось времени у них общая. Первый Вы, конечно же, узнали — это хорошо уже знакомый ПД. И хотя в этом издании большинство схем нарисовано с помощью простейших компьютерных приёмов, уверяем Вас — «живой» ПД на экране соответствующей регистрирующей аппаратуры будет выглядеть очень похоже. А вот второй график — это уже результат реконструкции «по экспериментальным точкам» целой серии последовательных опытов. В каждом опыте, напоминаем, мы должны чуть-чуть увеличивать интервал между первым и вторым стимулами. И получается удивительная вещь: обнаруживается относительно большой (это для нас 1 мс — незаметное мгновение, а для нейрона — целая вечность) отрезок времени, когда нейрон «не замечает» второй стимул, как будто его и не было.
Этот период частичной или полной нечувствительности мембраны к наносимым стимулам получил название рефрактерности (относительной или абсолютной соответственно). На этой стадии развития ПД для того, чтобы мембрана отреагировала на второй стимул, он должен быть значительно сильнее, чем первый; а во время абсолютной рефрактерности стимулировать нейрон вообще бесполезно.
Как Вы заметили, во время развития ПД есть два момента, когда возбудимость, наоборот, слегка повышена. Это начальный этап деполяризации (когда повторный стимул успевает «приплюсоваться» к первому — в самом деле, если мотор не заводится от стартёра, ему можно помочь заводной ручкой: вдвоём-то веселее!) и короткий момент следовой деполяризации (когда соотношение ионных градиентов ещё очень далеко от исходного).
Вот мы и добрались, по существу, до базовой причины невозбудимости мембраны. Совершенно очевидно, что проблема в нарушении ионной проводимости. А в чём конкретно?
Если Вы ещё не забыли, наряду с активационными воротами натриевые каналы имеют ещё и инактивационные. Если «залезть» на молекулярный уровень, белковые молекулы довольно инертны, и требуется время, чтобы они могли перейти из одного конформационного состояния в другое. Поэтому период, во время которого эти каналы не могут активироваться в ответ на новый стимул, достаточно значителен. Плюс к этому ещё и электрические характеристики мембраны во время деполяризации, овершута и реполяризации далеки от идеальных. В итоге реальная возбудимость мембраны в это время или крайне снижена (то есть пороги очень высоки), или отсутствует вообще.
У этого свойства ПД есть два очень важных следствия.
Первое: мы можем просчитать максимально возможные «скоростные» характеристики нейрона. Все, кому приходилось скачивать информацию с Интернета, хорошо понимают, насколько важной является «пропускная способность» канала связи. Наш мозг — это тоже информационная система (это ещё как сказать: «тоже»!), только в несчётное число раз более сложная и быстродействующая. Так как базовым мозговым кодом, по всей видимости, является пространственно-частотный, ясно, что максимально возможная для передачи по данному нейрону частота импульсов — чрезвычайно важный параметр. Для его обозначения наш великий соотечественник Введенский ввёл (извините за каламбур) 100 лет назад понятие лабильности. Лабильность — это максимальная частота импульсов, передаваемых или генерируемых нейроном в единицу времени.
А теперь вернёмся к понятию рефрактерности (рис. 40).
Если известно, что раньше завершения периода рефрактерности (то есть к началу следовых процессов) новый импульс возникнуть не может, мы можем рассчитать лабильность данного нейрона и единичный интервал принять за эталонный.
Исходя из этого, определённый паттерн импульсной активности мы можем описать в двоичном коде, используя единицы на месте импульсов и нули там, где ПД теоретически мог бы быть, но не состоялся. Несколько десятилетий назад такие «двоичные игры» были весьма популярны среди нейробиологов, но потом стало ясно, что так просто задача «расшифровки мыслей» не решается. Сегодня очевидно, что это только очень малая толика истины и разгадки мозговых кодов надо искать в пространственно-временных параметрах активности целых групп («ансамблей») нейронов или даже их отростков.
Второе следствие из данного свойства ПД заключается в том, что при распространении импульсов вдоль мембраны они бегут поступательно от места возникновения и никогда не кружатся на одном месте. Здесь тоже «виновата» рефрактерность, но к анализу этого следствия мы перейдём в рамках следующего, пятого свойства потенциала действия.
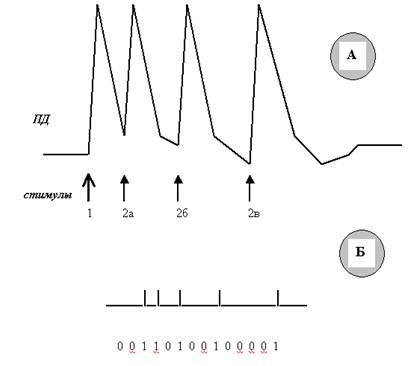
Рис. 40. На схеме А показано, что повторный ПД может возникнуть только «на выходе» из реполяризации первого ПД (точка 2а) или позже (точки 2б и 2в), но никак не раньше, то есть суммация ПД на мембране одного нейрона невозможна (вследствие рефрактерности). Схема Б имитирует возможный механизм двоичного кодирования в таком нейроне (1 — есть импульс, 0 — нет импульса, но мог бы быть в соответствии с лабильностью).
5. ПД распространяются по мембране бездекрементно (то есть без угасания)
Действительно, если мы вспомним механизм цикла Ходжкина, то сразу увидим способность нервных импульсов распространяться по мембране, ведь в каждое следующее мгновение открываются всё новые и новые натриевые каналы. А где их взять? Да на соседнем же участке мембраны, естественно. И причин для затухания ПД нет, пока не кончится электрогенная мембрана.
Казалось бы, что тут обсуждать? Оказывается, очень даже есть что! Дело в том, что в нашей нервной системе присутствуют два типа проводящих импульсы волокон (напоминаем, что волокна — не более, чем отростки нервных клеток: аксоны или дендриты).
Более древние — немиелинизированные (или безмякотные), и эволюционно более молодые — миелинизированные. И принципы безде-крементного распространения ПД по ним существенно различаются.
В немиелинизированном нервном волокне ПД распространяются с помощью механизма, очень похожего на движение волны по воде (если бы ещё эту волну в каждое мгновение кто-то подгонял, ведь энергия растрачивается). Представьте себе три последовательных этапа этого процесса (рис. 41).
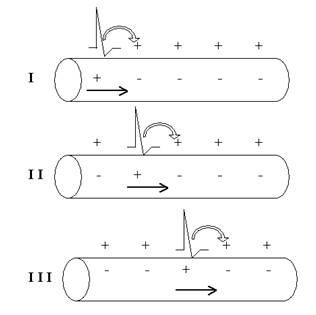
Рис. 41. Три «стоп-кадра», которые демонстрируют последовательные этапы распространения нервного импульса по немиелинизированному волокну. К сожалению, на бумаге очень трудно передать движение, динамику. Поэтому напрягите Ваше воображение, чтобы увидеть, как вспыхивающий в каждой новой точке мембраны ПД за счёт местных (локальных) токов деполяризует соседние участки, запуская там цикл Ходжкина. Этим токам «всё равно», что деполяризовать: ту мембрану, которая находится впереди, на пути распространяющегося ПД, или ту, по которой импульс только что прокатился. Но ведь есть 4-е свойство ПД, и благодаря рефрактерности остающийся «за спиной» участок мембраны не отвечает на деполяризацию. Поэтому ПД и распространяется вдоль нервного волокна, а не кружится на одном месте.
В первый момент времени на невозбуждённый участок мембраны поступает нервный импульс. За счёт местных токов он деполяризует соседний участок, запуская на нём цикл Ходжкина. Через активировавшиеся ионные каналы возникает лавинообразно нарастающий натриевый ток, что приводит к увеличению деполяризации мембраны вплоть до реверсии потенциала. Этот «вновь рождённый» ПД деполяризует следующий участок мембраны и т.д. Нервный импульс поступательно движется по мембране аксона от аксонного холмика до пресинаптического окончания, не угасая.
Прямо скажем, это очень надёжный механизм проведения сигнала, но, увы, довольно медленный: скорость проведения нервных импульсов по таким волокнам колеблется в пределах 0,3 — 15 м/с (в зависимости от толщины волокна, как Вы помните). Казалось бы, не так уж и медленно? Много ли в нашем теле метровых волокон? И тем не менее, для выживания в постоянно меняющихся условиях такой скорости, видимо, недостаточно. Такой забавный пример: если бы идущий от сетчатки глаза вглубь мозга зрительный нерв состоял из немиелинизированных волокон, то для получения той же скорости проведения информации, которая имеется у нас в реальности, потребовался бы нервный ствол диаметром… около 50 см! Представьте свои глазки на таких стебельках (точнее, пеньках) и поймёте, что что-то здесь не так.
Из чего же «сделан» настоящий человеческий зрительный нерв (кстати, он по толщине вполне сопоставим с просветом стержня от Вашей шариковой ручки)? В том-то и дело, что он состоит из быстропроводящих миелинизированных нервных волокон, скорость проведения импульсов в которых может достигать 120 м/с. Существенная разница, не правда ли? За счёт чего же возможен такой выигрыш? Попробуем разобраться.
Для этого вспомним строение миелинизированного нервного волокна (рис. 42). В отличие от безмякотного в нём мембрана через определённые промежутки покрыта муфтами из жироподобного вещества — миелина, спирально намотанного на поверхность волокна (которое, кстати, в этом случае называется осевым цилиндром). Эту работу по созданию миелиновых муфт выполняют сопутствующие нейронам шванновские клетки. Миелин — вовсе не электрический изолятор, как жизнерадостно пишут в последние годы авторы некоторых учебников. Повторю, что, к их огорчению, в нашем живом теле нет истинных изоляторов, так же как и надёжных проводников. Функция у этих муфт иная: на покрытых ими участках мембраны до крайности затруднён трансмембранный перенос ионов и, стало быть, нет механизма, способного обеспечить запуск цикла Ходжкина.
Рис. 42. По миелинизированному нервному волокну ПД распространяются сальтоторно, то есть «прыжками» от перехвата к перехвату Ранвье. Так как осевой цилиндр покрыт миелиновыми муфтами, под которыми трансмембранные ионные токи маловероятны, ПД «перескакивает» от перехвата к перехвату сугубо электротонически (вспомните локальный ответ!) — практически мгновенно, но с очевидным затуханием. Если бы не сверхвысокая возбудимость мембраны в перехватах Ранвье (а плотность ионных каналов там на два порядка выше, чем в обычной мембране), судьба нервных импульсов в таких волокнах была бы плачевна. Но эволюция ухитрилась найти такие параметры частоты перехватов и возбудимости, что миелинизированные волокна проводят ПД весьма надёжно и с высокой скоростью: ведь потери времени на ионные токи здесь остались только в перехватах. Изображённые пунктиром ПД должны проиллюстрировать идею электротонического затухающего проведения — это скорее образ, чем результат регистрации.
В результате мы видим гениальную находку природы: в миелинизированных волокнах нервные импульсы распространяются между перехватами Ранвье (оголёнными участками мембраны, находящимися между муфтами миелина) скачками, сальтоторно (от латинского глагола saltore — прыгать, скакать, кувыркаться). По существу, это электрический пробой. Учитывая миниатюрность нейронов, можно считать, что на эти скачки время вообще не тратится. Однако здесь есть небольшая неприятность: при электротоническом проведении потенциалы неуклонно гаснут по мере удаления от источника.
Но эта проблема устраняется за счёт чрезвычайно высокой возбудимости мембраны в перехватах Ранвье. В них плотность (то есть количество на единицу площади) ионных каналов очень высока (в 100 раз больше, чем в обычной мембране!), и даже почти совсем угасшего потенциала достаточно, чтобы запустить на такой мембране цикл Ходжкина. В результате время при сальтоторном проведении ПД тратится только на перекачку ионов через каналы в перехватах, и скорость распространения нервных импульсов в миелинизированных волокнах может быть на порядок (даже больше) выше, чем в немиелинизированных.
Маленькое заключение. Мы с Вами очень кратко рассмотрели пять базовых свойств ПД. Хочется ещё раз напомнить, что обратились мы к ним прежде всего потому, что эти знания лягут в основу понимания процессов биоэлектрогенеза в самых главных — с информационных позиций — узловых точках нейронной сети: синапсах. К этому вопросу мы и переходим.
4.4. Постсинаптические потенциалы
Подробное описание строения синапса и его свойств будет предметом следующей книжки. Надеюсь, в общих чертах это Вам знакомо (рис. 43).
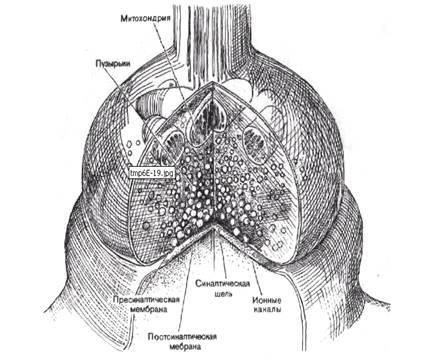
Рис. 43. Реконструкция синапса, на которой представлены его основные компоненты.
Сейчас же хотелось бы вкратце напомнить, что под синапсом понимают щелевой контакт между нейроном и другими возбудимыми клетками (не только нервной, но и мышечной или эндокринной), в котором происходит передача и переработка (!!!) информации (рис. 44). Пока мы не будем касаться особенностей работы электрических синапсов. Если бы мы были разумными ракообразными, это была бы наиважнейшая тема, но для нас, млекопитающих, гораздо важнее синапсы химические, потому что именно они формируют сложнейший информационный аппарат нашего мозга.
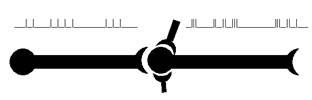
Рис. 44. Среди нескольких вариантов межнейрональных синапсов (аксо-аксональ-ные, аксо-дендритные, дендро-аксональные и т. д.) мы для анализа выбрали аксо-соматический синапс. Причём на этой нашей схеме магистральный синапс (по горизонтали) «отягощён» ещё двумя подобными ему. Будем считать, что сотни остальных остались где-то за плоскостью картинки. Обратите внимание на важную деталь: характеры импульсации в левом (передающем) нейроне и в правом (принимающем) существенно различны. То, что было недопустимым на уровне нервного волокна (изменение импульсного сигнала), становится чуть ли не обязательным для синаптической передачи.
Напоминаем, что на каждом из 1011 — 1012 нейронов, составляющих нашу нервную систему, в среднем сходится около 1000 синапсов. Каждый синапс — весьма сложно организованный аппарат, в котором имеется масса процессов и механизмов, большинство из которых просто бесполезно для простой передачи сигнала.
Вся история научного поиска учит, что природа до чрезвычайности ленива и никогда не будет создавать сложную систему там, где можно было бы обойтись простой. Это просто невыгодно, и эволюция с лёгкостью вымывает, элиминирует все «архитектурные излишества». Стало быть, очень усложнённая структура синапса призвана обслуживать и очень сложную функцию, а это никак не передача сигнала (вот уж для чего электрические синапсы оптимальны!), а именно его обработка.
Вот давайте и попробуем для начала проанализировать, какие особенности электрических процессов в химическом синапсе позволяют нейронам перерабатывать, а не просто пересылать информацию. Как работает химический синапс?
Для начала вспомним, как он устроен (рис. 45).
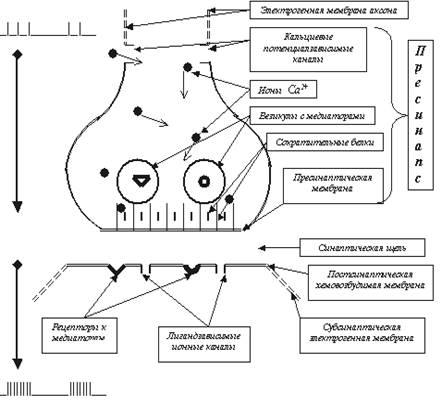
Рис. 45. Крайне упрощённая схема синапса, в которой из реального межнейронного контакта остались только принципиально значимые для обсуждения элементы.
Если на первых этапах не вдаваться в особо тонкие детали, то главными элементами химического синапса являются:
пресинаптическое окончание (пресинапс), на электрогенной мембране которого имеются потенциалзависимые кальциевые каналы (там есть и другие каналы, но пока в эти подробности вдаваться не будем), а внутри пресинапса расположены мембранные везикулы (пузырьки) с молекулами медиаторов. Непосредственно к обращённой в синаптическую щель пресинаптической мембране примыкают сократительные белки (SNARE-белки). отметим, что в каждом пресинапсе может присутствовать до 10000 везикул, в каждой из которых может быть до 10000 молекул разных (это принципиально важно!) медиаторов;
синаптическая щель, разделяющая передающий и принимающий информацию нейроны. Ширина этой щели около 40 нм (для сравнения: толщина клеточной мембраны около 20 нм);
постсинаптическая мембрана, на которой расположены рецепторные белки, способные с высоким сродством связываться с медиаторами и другими специфическими лигандами (например, ядами или лекарствами), и управляемые этими рецепторами лигандзависимые ионные каналы.
Безусловно, эта схема сугубо примитивно характеризует чрезвычайно сложный в реальности синапс, но для описания базового алгоритма его работы она достаточна.
А теперь сам короткий алгоритм (буквально по пунктам) передачи информации от нейрона к нейрону:
По электрогенной мембране (например, аксона) ПД достигает пресинапса (тем, кто уже забыл, как распространяются нервные импульсы по электрогенной мембране, неплохо бы отлистать эту книжку на несколько страниц назад).
Так как механизм распространения ПД включает в себя деполяризацию мембраны, то и мембрана пресинапса тоже деполяризуется.
В результате этой деполяризации активируются потенциалзависимые кальциевые каналы. В этом смысле они очень напоминают уже знакомые нам потенциалзависимые каналы, пропускающие по концентрационному градиенту ионы натрия и калия при генерации ПД.
Ионы кальция по градиенту концентрации проникают в пресинапс. Вообще о кальции стоит поговорить подробнее: это чрезвычайно «популярный» в биологических системах катион. Он абсолютно необходим и для прочности костей (без кальция их хоть узлом завязывай!), и для мышечных сокращений, и для системы свёртывания крови, и для иммунной системы, и для работы сердца, и т. д. Вот и синапс без ионов кальция работать не будет.
Кальций вызывает активацию сократительных белков пресинапса, и они дружно, синхронно притягивают везикулы с медиаторами к пресинаптической мембране, обращённой в синаптическую щель. И снова есть необходимость в уточнениях. Дело в том, что сократительные белки пресинапса (так называемые SNARE-белки) и по химическим свойствам, и по механизмам функционирования чрезвычайно похожи на сократительные белки нашей поперечно-полосатой мускулатуры. Поэтому имеет смысл чуть более детально остановиться на том, как работают наши скелетные мышцы (рис. 46).
Главными рабочими элементами каждого мышечного волокна являются фибриллярные (нитчатые) белки: актин и миозин. Миозин значительно крупнее и тяжелее, чем актин. Эти белки расположены в мышечном волокне квазипараллельно, подобно зубцам двух расчёсок, направленных навстречу друг другу. Уникальной особенностью актина и миозина является их способность динамически взаимодействовать друг с другом путём образования временных химических «мостиков».
|
|
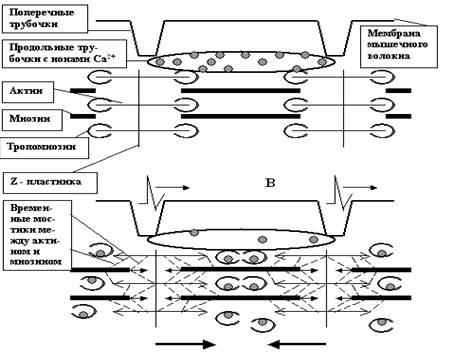
Рис. 46. Схематическое изображение процесса сокращения мышечного волокна. А — локальный участок (фрагмент саркомера) мышечного волокна в покое: между квазипараллельными фибриллярными молекулами сократительных белков актина и миозина расположен блокирующий белок тропомиозин, препятствующий взаимодействию этих белков. В — деполяризующие мембрану мышечного волокна (в том числе и мембрану поперечных трубочек) потенциалы действия опосредованно активируют (пока ещё не совсем ясно, как именно, хотя гипотезы есть вполне красивые) кальциевые каналы терминальных цистерн продольных трубочек, и ионы Ca2+ по градиенту концентрации выходят из продольных трубочек в область сократительных белков; в результате тропонин (белок-сателлит тропомиозина) связывается с ионами Ca2+, снимая тропомиозиновый блок; между освобождёнными нитями актина и миозина возникает динамическое взаимодействие: формируются временные мостики, перемещающиеся вдоль нитей (подобно рукам участников двух команд, перетягивающих канат) и обеспечивающие скольжение нитей актина и миозина навстречу друг другу. Если внимательно приглядеться, можно увидеть, что на схеме В Z-пластинки расположены ближе друг к другу, чем на рис. А, то есть саркомер укоротился (мышца сократилась). Кстати, наши мышцы могут укорачиваться на 50% своей длины.
Эти мостики пробрасываются от миозина к актину, быстро меняют угол своего прикрепления (белки «подтягиваются» за них навстречу друг другу), отсоединяются, перемещаются вперёд, снова подтягиваются и т. д. В результате нити сократительных белков начинают скользить друг навстречу другу, и мышца сокращается. Естественно, что этот механизм «скользящих нитей» весьма энергозатратен, — ведь мы хорошо знакомы с усталостью после физической работы. В детали этих энергетических процессов мы вдаваться не будем — они выходят за рамки данного раздела.
Гораздо важнее для нас, почему же это происходит не всегда, а только «по приказу» от мотонейрона? Дело в том, что в покое нити актина и миозина разобщены блокирующим белком тропомиозином и их взаимодействие невозможно. Для снятия этого блока нужно, чтобы тропомиозин изменил свою конформацию, а это, в свою очередь, достигается при взаимодействии ещё одного белка — тропонина (белка-саттелита тропомиозина) с ионами Ca2+. Тропонин — типичный представитель довольно обширного семейства кальцийсвязывающих белков (ещё один яркий пример такого белка — кальмодулин, играющий роль второго посредника, то есть внутриклеточного переносчика информации. Наберитесь терпения — об этом поговорим чуть позже).
И вот отсюда становится понятной роль кальция: высвободившись в результате деполяризующего действия ПД из терминальных цистерн продольных трубочек (вполне тривиальные для клетки мембранные структуры — вспомним комплекс Гольджи, эндоплазматический ретикулум и т. п.), он диффундирует к сократительным белкам, связывается с тропонином и таким образом снимает блокировку с акто-миозинового взаимодействия. Значит, активация сократительных белков происходит не случайно, не спонтанно, а исключительно под влиянием ПД, то есть управляемо.
А теперь вернёмся к пресинапсу. Аналогия между SNARE — белками и сократительными белками мышечного волокна — пусть и не абсолютно точная, но вполне допустимая. И кальций здесь отрабатывает ту же роль. Только задача в пресинапсе другая: не обеспечить сокращение нейрона (ещё не хватало, чтобы «шевеление мозгами» происходило буквально!), а добиться одновременного, сугубо синхронизированного притягивания множества везикул с медиаторами к пресинаптической мембране. То есть опять же — процесс высвобождения медиаторов идёт не спонтанно, не хаотично (такое, впрочем, случается, в своё время мы поговорим о так называемых МПКП), а управляемо, в ответ на приход ПД в пресинапс.
При взаимодействии пресинаптической мембраны с везикулярными мембранами везикулы лопаются, и молекулы медиаторов высвобождаются в синаптическую щель (экзоцитоз). Этот процесс тоже заслуживает особого комментария (рис. 47).
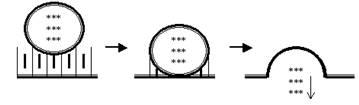
Рис. 47. Схема экзоцитоза. Везикулы, заполненные молекулами медиаторов, сталкиваются с пресинаптической мембраной и вскрываются в синаптическую щель. В результате множество (около 10000 в каждой везикуле) молекул медиаторов оказывается в узком (до 40 нм) щелевом пространстве между передающей и принимающей информацию клетками.
В принципе, слияние двух липидных мембран при их простом соприкосновении — процесс, термодинамически вполне естественный. Представьте себе две янтарные капельки жира в тарелке с горячим (!!) бульоном. Достаточно согнать их ложкой вместе, слегка ткнуть этой же ложкой вдоль получившейся восьмёрки, и на Ваших глазах из двух капель получится одна большая. Отработает гидрофобность жирнокислотных «хвостов» липидных молекул, категорически не желающих общаться с водной фазой. Однако наш мозг — всё же не бульон с капельками жира, поэтому процесс экзоцитоза посложнее, чем только что описанный. Сегодня открыта целая команда мембранных белков, принимающих в нём участие, да и ионы кальция нужны для активации не только SNARE-белков, но и самого экзоцитоза. К сожалению, эти интересные детали далеко выходят за рамки нашего курса.
Высвободившиеся из везикул молекулы медиаторов диффундируют через синаптическую щель к постсинаптической мембране. Нужно заметить, что за один цикл (то есть в ответ на один ПД) из пресинапса одновременно высвободится содержимое примерно 10000 везикул, то есть около 100000000 молекул медиаторов. Молекулы медиаторов с высоким сродством («высокоаффинно») связываются со своими специфическими рецепторами и активируют их. И этот процесс заслуживает особого рассмотрения (рис. 48). Нам ещё предстоит серьёзный разговор о многочисленных медиаторах и других информонах. Однако сейчас имеет смысл приглядеться к самым важным проблемам лиганд-рецепторных взаимодействий. И прежде всего это принцип комплементарности, согласно которому медиаторы связываются сугубо со «своими» рецепторами (например, ацетилхолин — с холинорецептором, адреналин — с адренорецептором, и т. д.).
Рис. 48. Принцип комплементарного связывания медиаторов сугубо со «своими» рецепторами на первый взгляд прост и примитивен. «Ключ к замку», «рука к перчатке» — всем знакомы такие метафоры, описывающие этот принцип (например, антиген-антитело, фермент-субстрат и т. п.). Нужно всего лишь, чтобы две взаимодействующие молекулы зеркально, подобно пазлам, подходили друг к другу (пространственно, энергетически, ещё как-нибудь…). И, казалось бы, при современных возможностях физико-химических методов ничего не стоит доказать эту идею. Однако мы не имеем пока прямых доказательств и опираемся только или на математические модели, или на косвенные данные (например, результаты фармакологического анализа). Есть ещё и проблема чисто теоретического плана: в последние десятилетия открыто множество биологически активных веществ (в первую очередь, медиаторов), способных высокоспецифично связываться с белковыми сайтами мембраны, то есть рецепторами. Прогресс в этой области явно не собирается тормозиться, так что уже скоро счёт таких веществ (рецепторных лигандов) пойдёт на сотни, а то и на тысячи. Возникает резонное недоумение: сколько же генетической памяти надо потратить, чтобы закодировать этакую прорву специализированных рецепторных белков?! Нет у нас такого запаса ДНК — на все случаи жизни! Так что исследовать ещё и исследовать…
Механизмы таких лиганд-рецепторных взаимодействий достаточно неплохо изучены, но их детализация выходит за рамки этого издания.
Второй важный момент заключается в том, что активация рецептора (то есть изменение его энергетики и конформации) происходит мгновенно, именно в тот миг, когда идет прямое химическое взаимодействие крохотной молекулы медиатора и громадного рецепторного белка. Активированные рецепторные белки, в свою очередь, активируют систему передаточных (G-) белков, которые одним из двух возможных способов (рис. 49, 50) открывают лигандзависимые ионные каналы постсинаптической мембраны.
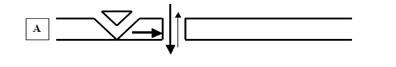
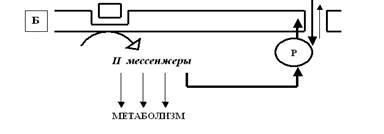
Рис. 49. На чрезвычайно упрощённой схеме представлены два принципиальных механизма активации лигандзависимых ионных каналов. А — «быстрый» способ, который реализуется при активации медиатором ионотропных рецепторов постсинаптической мембраны. Так как данные рецепторы являются, по существу, элементами ионного канала (напомню, что каналы — это надмолекулярные белковые комплексы, состоящие из нескольких субъединиц белка), процесс активации происходит практически мгновенно, без потерь времени. Б — «медленный» механизм, при котором активация рецептора запускает систему II мессенжеров (это внутриклеточные передатчики информации; речь о них пойдёт чуть позже), которые способны активировать различные метаболические каскады внутри клетки, в том числе процесс фосфорилирования (обозначено на схеме буквой Р) канальных белков. В результате лигандзависимые каналы переходят в активированное состояние и могут оставаться открытыми не несколько миллисекунд (как в «быстром» способе), а секунды, минуты и даже часы. Рецепторы, запускающие такой механизм, получили название метаботропных. Ещё раз подчеркну, что схема не учитывает очень многие детали процесса активации каналов (например, участие в нём G-белков и фосфолипидов мембраны) и иллюстрирует только главные этапы.
Первый способ получил название «быстрого», при нём рецептор и канал — это, по сути, единый комплекс, и активация ионотропных рецепторов (способных только активировать ионные каналы) приводит к быстрому и непродолжительному открыванию ионных каналов постсинаптической мембраны.
Второй способ — «медленный»: активированные медиаторами метаботропные рецепторы (способные влиять на обмен веществ — метаболизм — в клетке) запускают систему II мессенжеров, которые, в свою очередь, стимулируют цепочку биохимических реакций, приводящих в конечном итоге к фосфорилированию мембранных канальных белков; в результате ионные каналы открываются медленнее, но открытыми могут оставаться существенно дольше, чем в первом случае (секунду, минуты и даже часы).
Есть необходимость сказать два слова о II мессенжерах.
Когда в начале 60-х годов прошлого века Сазерленд открыл первый из вторых мессенжеров (именно «вторых», а не «вторичных», как по недомыслию закрепилось в нашей литературе) — циклический аденозинмонофосфат (цАМФ), это стало настоящим событием! К этому времени давно уже были открыты межклеточные химические коммуникаторы: гормоны (первый в истории гормон — секретин — был открыт Бейлиссом и Старлингом в далёком 1902 году) и медиаторы (здесь приоритет принадлежит Отто Леви, который в 1920 году доказал медиаторную функцию ацетилхолина, за что был удостоен Нобелевской премии).
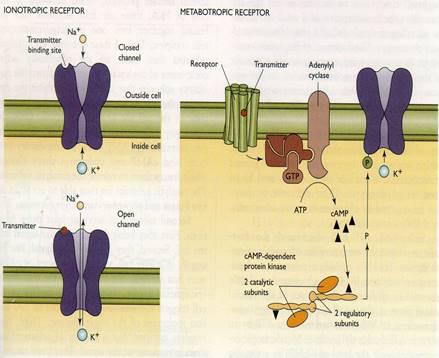
Рис. 50. Более совершенная в художественном смысле реконструкция ионотропных и метаботропных рецепторов и управляемых ими каналов, показанных на рис. 49.
Открытие Сазерленда стало следующим шагом в понимании химических механизмов передачи информации в живых системах. За без малого полвека удалось обнаружить не так уж много II мессенжеров. Кроме цАМФ, это его «собрат» — ещё один циклический нуклеотид цГМФ (циклический гуанозинмонофосфат), кальцийсвязывающий белок кальмодулин, некоторые фосфолипиды мембраны (например, инозитол-3-фосфат, диацилглицерол) и, что стало научной сенсацией конца ХХ века, совсем уж простые молекулы типа оксида азота (NO).
Несмотря на невеликое количество этих внутриклеточных посредников, их роль в работе клеток чрезвычайно значительна. В следующем издании я надеюсь познакомить Вас с этим более подробно, но уже сейчас возьмите на заметку, что чашка чаю или кофе бодрит именно потому, что кофеин стимулирует систему II мессенжеров.
Однако продолжим путешествие по синапсу. Что за каналы открываются «по приказу» рецепторов?
Это очень важно понять. так как на постсинаптической мембране ионные каналы принципиально отличаются от тех, которые мы рассматривали при анализе ПД, характер ионных токов, и соответственно потенциалов, будет очень существенно отличаться от тех, которые формируют нервные импульсы:
а) во-первых, каналы постсинаптической мембраны являются лигандзависимыми, а не потенциалзависимыми, то есть эти каналы активируются исключительно «по команде» рецептора и принципиально неадекватно реагируют на изменения потенциала, поэтому цикл Ходжкина на них запустить невозможно;
б) во-вторых, эти каналы значительно менее селективны, чем потенциалзависимые, поэтому через них возможны даже встречные потоки ионов. Например, на постсинаптической мембране различают Na+—K+-каналы и Cl-— K+-каналы (рис. 51, 52);
в) в-третьих, длительность активированного состояния таких каналов значительно больше, чем у потенциалзависимых (для каналов, активированных ионотропными рецепторами, больше примерно в 5 раз, а для управляемых с метаботропных рецепторов — секунды, минуты и даже часы!).
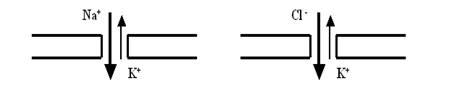
Рис. 51. На постсинаптической мембране главную роль играют два типа лигандзависимых каналов: Na+—K+ и Cl–—K+. Они значительно менее селективны, чем потенциалзависимые (причём определяющими для изменения потенциала мембраны являются потоки ионов натрия и хлора, а не калия), и гораздо дольше остаются в открытом состоянии.
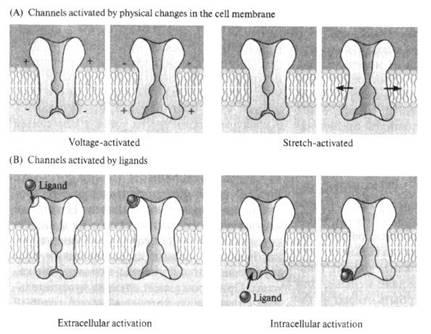
Рис. 52. Очень, на мой взгляд, выразительные схемы двух видов (и двух подвидов) ионных каналов, управляемых физическими (А) и химическими (В) стимулами. А — потенциалзависимые (слева) и механозависимые (справа) каналы; В — слева показан канал, активирующийся медиатором, справа — активирующийся через запуск системы II мессенжеров.
Исходя из этих особенностей каналов постсинаптической мембраны, сами постсинаптические потенциалы (ПСП) также вопиюще не совпадают по своим свойствам с потенциалами действия (табл. 1):
1) ПСП не подчиняются закону «всё или ничего», так как на постсинаптической мембране нет субстрата для его воспроизведения — потенциалзависимых каналов. Поэтому ПСП относятся к электротоническим процессам и способны меняться градуально: чем больше ионных каналов активировалось, тем больше (по модулю) будет сам потенциал.
2) длительность ПСП всегда значительно больше, чем у ПД (минимум в 5 раз).
3) в отличие от ПД, ПСП могут быть как деполяризационными
(в случае активации Na+—K+-каналов), так и гиперполяризационными (если активируются Cl–—K+-каналы).
Таким образом, во-первых, мы видим, что уже по первым трём свойствам градуальные постсинаптические потенциалы принципиально отличаются от потенциалов действия.
Во-вторых, самое время вспомнить, что при рассмотрении первых трёх свойств ПД мы обсуждали прежде всего условия его генерирования (напомню: стартовый стимул должен быть надпороговым по амплитуде и по длительности, а также катодическим). С учетом «задач» ПСП (обеспечить возникновение ПД на электрогенной мембране) особенности его свойств становятся всё более актуальными — не для имитации ли постсинаптических процессов существуют электростимуляторы, а? Подумайте об этом! Однако вернёмся пока к нашему алгоритму.
Таблица 1. Сравнительная характеристика потенциалов действия (ПД)
и постсинаптических потенциалов (ПСП)
Потенциалы |
Постсинаптические |
Возникают вследствие активации потенциалзависимых ионных каналов |
Возникают при активации лигандзависимых ионных каналов |
Подчиняются закону «всё или ничего»: возникают только при надпороговых значениях стимула и всегда одинаковы |
Не подчиняются этому закону и могут меняться градуально (в зависимости от соотношения ионных токов) |
Чрезвычайно кратковременны |
Значительно (более, чем в 5 раз) длительнее |
Однополярны: всегда начальная деполяризация с последующей гиперполяризацией |
ВПСП — деполяризация (соответствует катоду); ТПСП — гиперполяризация (соответствует аноду) |
Никогда не суммируются на мембране одного нейрона |
Есть пространственная и временная суммация как на внутрисинаптическом, так и межсинаптическом уровне |
Распространяются бездекрементно за счёт перманентного «самовозрождения» через цикл Ходжкина |
Электротонические потенциалы: угасают в связи с отсутствием изоляторов в живых организмах |
4) Как Вы, надеюсь, помните, потенциалы действия не суммируются на одном волокне (из-за наличия рефрактерности). Для ПСП таких запретов не существует: убедительно доказано, что постсинаптические потенциалы могут суммироваться, причём эта суммация может быть как пространственной, так и временной. Следовательно, к градуальности каждого ПСП добавляется ещё и возможность суммации множества потенциалов, возникших более-менее одновременно на нескольких соседних синапсах. Причём такая суммация может привести и к наращиванию ПСП (если суммируются ВПСП), так и к его вырождению (когда в процесс вмешиваются ещё и ТПСП).
5) Наконец, в отличие от ПД, постсинаптические потенциалы распространяются с угасанием, ведь на постсинаптической мембране нет субстрата для формирования цикла Ходжкина (и соответственно бездекрементного проведения) — потенциалзависимых ионных каналов.
А вот теперь самое главное: мы можем попытаться понять, каким образом возникающие на постсинаптической мембране Na+, K+ и Cl– ионные токи формируют постсинаптические потенциалы, и как затем эти ВПСП/ТПСП, многократно суммируясь и неизбежно угасая, обеспечивают возникновение разного количества ПД на электрогенной мембране за пределами синапсов (прежде всего в аксональном холмике нейрона). По существу, можно повторить наше обсуждение механизмов генерации ПД, в ходе которого мы подавали начальный стимул с помощью электростимулятора. Напомню, что этот стимул должен быть надпороговой амплитуды (силы), надпороговой длительности и обязательно катодическим. Теперь представьте себе, что в результате суммации ВПСП и ТПСП у нас сформировался некий ПСП, отвечающий всем этим требованиям, то есть сумма ВПСП оказалась заведомо больше суммы ТПСП. Можем ли мы быть уверены в том, что теперь за возникновение ПД на электрогенной мембране принимающего нейрона можно не беспокоиться? Увы, нет. Потому что электротонический характер ПСП не даёт никаких гарантий по поводу того, будет ли достигший электрогенной субсинаптической мембраны суммарный постсинаптический потенциал надпороговым для генерации там ПД или угаснет до подпорогового уровня.
11. Казалось бы, вопрос о синаптической передаче информации исчерпан. Исходный набор нервных импульсов, пройдя через несколько перекодирований, преобразовался в конечный набор, как правило, отличающийся от исходного. И механизмы этих перекодирований более-менее понятны. Но есть ещё одна немаловажная деталь в алгоритме работы синапса. В 7-м пункте нашего обсуждения мы говорили о том, что медиаторы, высокоспецифично связываясь с мембранными рецепторами, активируют их. Сам процесс активации с энергетических позиций выглядит достаточно очевидным: конформация белковой молекулы (а рецептор, напомню, — белок) в большой мере зависит от её энергии, то есть при прочих равных условиях белок «выбирает» такую(-ие) конформацию (-ии), в которой его молекула обладает минимумом свободной энергии. При взаимодействии маленькой молекулы медиатора с огромной рецепторной молекулой энергетическое состояние белка-рецептора на короткий миг меняется, и соответственно меняется и его конформация. Этого мига достаточно, чтобы активировать дальнейшие процессы в мембране (вспомним G-белок!) и передать информацию по цепочке дальше. А что же медиатор? Ведь он свою роль уже исполнил? Что ж, «мавр сделал своё дело и мавр может уйти». Даже не может, а должен! Должен, потому что импульсы поступают в пресинапс один за другим, выделяются всё новые и новые порции медиаторов, а с чем эти молекулы будут связываться, если рецептор ещё занят? Чтобы такого не случилось, существует несколько молекулярных «дворников», которые должны быстро очистить рецептор от отработавшего медиатора. Трёх главных «блюстителей чистоты» Вы сейчас увидите.
1) Ферментативное расщепление медиатора (рис. 53). Взаимодействие медиатора с рецептором вызывает активацию фермента, как правило, связанного с постсинаптической мембраной. Фермент катализирует реакцию распада молекулы медиатора, и рецептор очищается. Так, например, происходит инактивация самого известного из медиаторов — ацетилхолина.
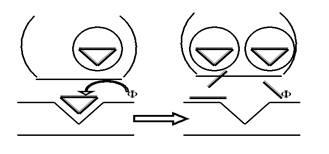
Рис. 53. Благодаря ферментативному катализу молекула медиатора распадается на отдельные компоненты непосредственно в синаптической щели. Компоненты утилизируются (в том числе могут пойти на синтез новых молекул медиаторов), а очищенный рецептор готов к приёму следующей порции медиатора.
2) Обратный захват медиатора (рис. 54). После взаимодействия медиатора с рецептором запускается система белков-транспортеров, которые возвращают медиатор в пресинаптическое окончание (своего рода «безотходное производство»).
3) Интернализация рецептора. Этот сравнительно недавно открытый механизм очистки рецептора от отработавшего медиатора может лечь в основу объяснения одного из базовых механизмов наркотической толерантности/зависимости. Поэтому рассмотрим его более детально (рис. 55).
Интернализация рецептора представляет собой очень быстрый (по некоторым данным, несколько микросекунд) процесс, реализующийся через несколько этапов:
медиатор связывается с рецептором и активирует его; рецептор транслирует сигнал в клетку, а медиатор становится для него «обузой», от которой надо избавиться;
рецептор вместе с медиатором и частью липидного бислоя «ныряет» в цитоплазму и замыкается в микровезикулу;
на комплекс «медиатор-рецептор» набрасываются ферменты (учитывая, что интернализация характерна для рецепторов к медиаторам пептидной природы, это пептидазы) и расщепляют молекулу медиатора;
освободившийся от медиатора рецептор «всплывает» на мембрану (сразу же или в ответ на новый синаптический сигнал) — он готов к новым информационным подвигам!
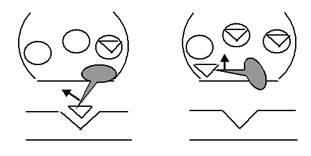
Рис. 54. Чрезвычайно упрощенная иллюстрация механизма обратного захвата медиаторов (например, моноаминов) или их отдельных фрагментов. Трудно представить, что, управляя этим процессом, можно вытащить человека из тяжёлой депрессии. Однако это факт…
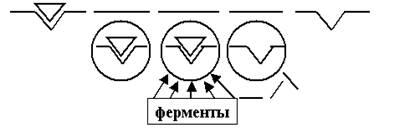
Рис. 55. Упрощенная схема процесса интернализации рецептора. Показаны последовательные этапы: активированный медиатором рецептор, успев передать сигнал дальше, «тонет» под мембрану; в подмембранном пространстве медиатор подвергается ферментативному расщеплению, а освободившийся от него рецептор возвращается на мембрану. Нарушение этого процесса (на этапе ферментативного расщепления) при наркомании является одной из базовых причин толерантности/зависимости.
Маленькое заключение. Таким образом, мы вкратце рассмотрели базовый механизм передачи сигнала в химическом синапсе (рис. 56).
По существу, мы убедились, что закодированная последовательностью нервных импульсов информация, как минимум, три раза меняет в процессе синаптической передачи свой материальный «субстрат»:
а) первое преобразование происходит в пресинапсе, когда ПД провоцирует выделение медиаторов, и информация, образно выражаясь, переносится на химический носитель — медиатор;
б) второе перекодирование — это формирование градуальных постсинаптических потенциалов вследствие активации медиаторами рецепторов и последующей активации ионных каналов постсинаптической мембраны;
в) и третий шаг — генерация новой последовательности нервных импульсов в аксонном холмике под влиянием постсинаптических потенциалов всех активированных на текущий момент синапсов.
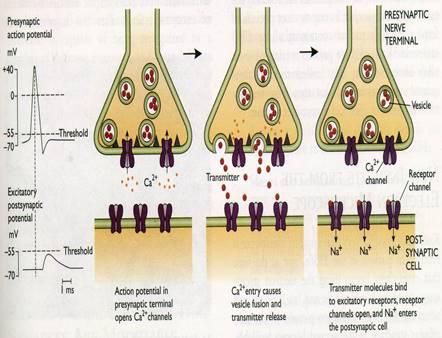
Рис. 56. Вы видите последовательность событий в чрезвычайно примитивном химическом синапсе, в котором присутствует только один вид медиатора. Активация постсинаптической мембраны происходит только через ионотропные рецепторы, а натриевый ток через каналы постсинаптической мембраны формирует исключительно ВПСП. В реальных синапсах всё, как правило, гораздо сложнее…
Вместо заключения
Надеюсь, прочитанные Вами страницы хоть в некоторой степени позволили Вам представить себе, какие электрические процессы в нейронах обеспечивают передачу и переработку информации в нервной системе. Если так — значит, книжка писалась не зря!
Напоминаю, что это пособие написано для тех, кто делает первые шаги к пониманию работы мозга (не так важно, кто это: физики, психологи, математики, биологи…). Поэтому и нарочито упрощённый язык, и ограниченный круг вопросов, которые здесь рассмотрены. Ведь даже просто история изучения «живого электричества», начавшаяся несколько веков назад с Л. Гальвани и А. Вольта, — это уже бесконечно увлекательная сага о великих находках, искренних заблуждениях и цистернах пролитого пота (и крови, между прочим, правда, в основном крови экспериментальных животных).
Сегодняшний день электробиологии — это гимн точности измерений на самых разных уровнях, и прежде всего на микроуровне (очень модная сегодня приставка «нано-» — это ведь как раз про клеточную и молекулярную нейробиологию: здесь и нанометры, и нановольты, и наномоли). А там, где измерено, там в конечном итоге и понято!
Однако рискну напомнить, что мозг — это не только электрическая, но и химическая «машина». Поэтому не советую расслабляться: следующее издание — про медиаторы, гормоны и другие информоны — уже на компьютере.
Так что, ДО ВСТРЕЧИ!
1. Албертс, Б. Молекулярная биология клетки. В 3 т. / Б. Албертс, Д. Брей, Дж. Льюис, М. Рэфф, К. Робертс, Дж. Уотсон. — М. : Мир, 1994.
2. Ашмарин, И. П. Нейрохимия / И. П. Ашмарин. — М. : МГУ, 1996.
3. Блум, Ф. Мозг, разум, поведение / Ф. Блум, А. Лейзерсон, Л. Хофстедтер. — М. : Мир, 1988.
4. Буреш, Я. Методики и основные эксперименты по изучению мозга и поведения / Я. Буреш, О. Бурешова, Д. П. Хьюстон ; пер. с англ. ; под ред. А. С. Батуева. — М. : Высшая школа, 1991.
5. Катц, Б. Нерв, мышца, синапс / Б. Катц. — М. : Мир, 1968.
6. Катцунг, Б. Г. Базисная и клиническая фармакология / Б. Г. Катцунг. — М. : Бином ; СПб. : Невский диалект, 1998.
7. Коган, А. Б. Основы физиологии высшей нервной деятельности / А. Б. Коган. — М. : Высшая школа, 1988.
8. Костюк, П. Г. Кальций и клеточная проводимость / П. Г. Костюк. — М. : Наука, 1984.
9. Костюк, П. Г. Механизмы электрической возбудимости нервной клетки / П. Г. Костюк, О. А. Крышталь. — М. : Наука, 1981.
10. Костюк, П. Г. Внутриклеточная сигнализация / П. Г. Костюк, М. А. Островский. — М. : Наука, 1988.
11. Крутецкая, З. И. Механизмы внутриклеточной сигнализации / З. И. Крутецкая, О. Е. Лебедев, Л. С. Курилова. — СПб. : Изд-во СПбГУ, 2003.
12. Куффлер, С. От нейрона к мозгу / С. Куффлер, Дж. Г. Николлс. — М. : Мир, 1979.
13. Кэндел, Э. Клеточные основы поведения / Э. Кэндел. — М. : Мир, 1980.
14. Мозг / пер. с англ. Н. Ю. Алексеенко ; под ред. и с предисл. П. В. Симонова. — М. : Мир, 1984.
15. Николлс, Дж. Г. От нейрона к мозгу / Дж. Г. Николлс, А. Р. Мартин, Б. Дж. Валлас, П. А. Фукс ; пер. с англ. П. М. Балабана, А. В. Галкина, Р. А. Гиниатуллина, Р. Н. Хазипова, Л. С. Хируга. — М. : Едиториал УРСС, 2003.
16. Орлов, Б. Н. Пептидэргические механизмы нейроэндокринной регуляции функций организма : учебное пособие / Б. Н. Орлов, С. Б. Парин. — Г. : Изд-во ГГУ, 1986.
17. Раевский, К. С. Медиаторные аминокислоты / К. С. Раевский, В. П. Георгиев. — М., 1986.
18. Розен, В. Б. Основы эндокринологии / В. Б. Розен. — М. : МГУ, 1994.
19. Ройтбак, А. И. Глия и её роль в нервной деятельности / А. И. Ройтбак. — СПб. : Наука, 1993.
20. Симонов, П. В. Лекции о работе головного мозга / П. В. Симонов. — М. : Ин-т психологии РАН, 1998.
21. Сторожук, В. М. Нейронные механизмы обучения / В. М. Сторожук. — Киев : Наукова думка, 1986.
22. Харкевич, Д. А. Фармакология / Д. А. Харкевич. — М. : ГЭОТАР Медицина, 1999.
23. Харрисон, Д. Биология человека / Д. Харрисон, Д. Уайнер, Д. Теннер, Н. Барникот. — М. : Мир, 1979.
24. Ходжкин, А. Нервный импульс / А. Ходжкин. — М. : ИЛ, 1965.
25. Хомутов, А. Е. Физиология центральной нервной системы : учебное пособие / А. Е. Хомутов. — Ростов н/Д : Феникс, 2006. — (Высшее образование).
26. Хомутов, А. Е. Анатомия центральной нервной системы : учебное пособие / А. Е. Хомутов, С. Н. Кульба. — Ростов н/Д : Феникс, 2005. — (Высшее образование).
27. Хомутов, А. Е. Нейрология / А. Е. Хомутов, С. Б. Парин. — Н. Новгород : Изд-во ННГУ, 1999.
28. Хухо, Ф. Нейрохимия. Основы и принципы / Ф. Хухо. — М. : Мир, 1990.
29. Шеперд, Г. Нейробиология. В 2 т. / Г. Шеперд. — М. : Мир, 1987.
30. Шмидт, Р. Ф. Физиология человека. В 3 т. / Р. Ф. Шмидт, Г. Тевс [и др.]. — М. : Мир, 1996.
31. Шульговский, В. В. Основы нейрофизиологии / В. В. Шульговский. — М. : МГУ, 2000.
32. Шульговский, В. В. Физиология центральной нервной системы / В. В. Шульговский. — М. : МГУ, 1997.
33. Эккерт, Р. Физиология животных. Механизмы и адаптация / Р. Эккерт, Д. Рэнделл, Дж. Огастин. — М. : Мир, 1991.
34. Экклс, Дж. Физиология нервной клетки / Дж. Экклс. — М. : Мир, 1959.
35. Экклс, Дж. Физиология синапсов / Дж. Экклс. — М. : Мир, 1989.
Содержание
Введение............................................................................................. 3
1. Понятие биоэлектрогенеза. Возбудимость. Возбудимые клетки......... 5
2. Морфо-функциональная характеристика мембраны возбудимых
клеток.............................................................................................. 6
3. Ионный транспорт: каналы и насосы............................................... 11
4. Мембранные потенциалы: ПП, ПД, ВПСП, ТПСП, МПКП,
ПКП и т. д........................................................................................ 20
4.1. Потенциал покоя (ПП) мембраны и причины его
возникновения.......................................................................... 20
4.2. Потенциал действия (ПД), или нервный импульс (спайк)............ 28
4.3. Свойства потенциала действия (ПД).......................................... 37
4.4. Постсинаптические потенциалы................................................ 51
Вместо заключения............................................................................ 68
Литература........................................................................................ 69
Сергей Борисович Парин
Особенности биоэлектрогенеза
Принципы переработки информации
в нервной системе
Методическое пособие
Редактирование и верстка Н. Н. Кралиной
Подписано в печать --.11.08.
Формат 60 90 1/16. Бумага офсетная №1.
90 1/16. Бумага офсетная №1.
Усл. печ. л. 4,5. Уч.-изд. л. 4,0. Тираж 300 экз. Заказ № 109(2008).
Отпечатано в типографии Института прикладной физики РАН,
603950 г. Н. Новгород, ул. Ульянова, 46