

Саморегулируемый мозг и нейробиоуправление:
экспериментальные и клинические перспективы
(перевод на русский язык – Федотчев А.И., fedotchev@mail.ru)
Neurofeedback (нейробиоуправление), один из первичных примеров саморегулирования, представляет собой совокупность методов, которые обучают мозг и помогают улучшить его функции. С момента прихода на сцену в 1960-е годы, основанное на электроэнцефалографии (ЭЭГ) нейробиоуправление стало лечебным инструментом для множества психических расстройств; однако, его клиническая эффективность остается спорной. Современные технологии визуализации живого человеческого мозга (например, функциональная магнитно-резонансная томография в реальном времени) и все более строгие протоколы исследований, использующие такие методологии, начинают проливать свет на глубинные механизмы, которые могут способствовать развитию более эффективных клинических применений. В данной работе мы ориентируемся на последние технологические достижения в области визуализации человеческого мозга и обсуждаем, как эти современные методы могут влиять на сферу нейробиоуправления. С этой целью мы описываем современное состояние и намечаем будущие направления для дальнейшего изучения потенциальных достоинств этого вызывающего споры терапевтического средства.
Ключевые слова: саморегуляция, нейровизуализация, функциональная магнитно-резонансная томография в реальном времени (real time fMRI), психиатрия, нейробиоуправление
1. Введение
Neurofeedback относится к технике саморегулирования, которая обеспечивает индивидууму обратную связь о специфической активности мозга, связанной с поведением. Базовое предположение, лежащее в основе этой практики, утверждает, что благодаря этому типу обратной связи можно вовлекать, изменять и регулировать нейронную активность. Этот подход увлекает как исследователей, так и практиков, которые хотят понять нейробиологические механизмы и терапевтический потенциал, который такой подход может предлагать. Кроме электроэнцефалографии (ЭЭГ), появление современной технологии визуализации головного мозга в реальном масштабе времени проливает свет на временные параметры и локализацию мозговой активности, открывая путь к новым перспективам, в том числе для модуляции непроизвольных нейронных функций (рис. 1).
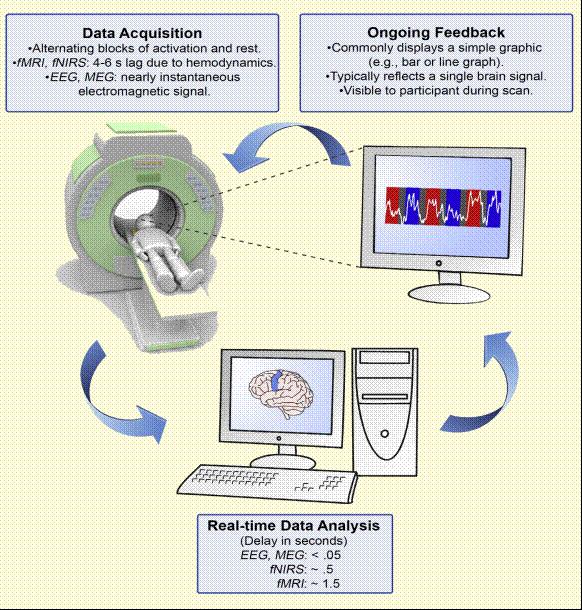
Рис. 1. Концептуальная схема, изображающая rtfMRI левой первичной моторной коры.
Вместе с тем, нейробиоуправление, основанное на визуализации, с трудом переходит от лабораторий когнитивной неврологии до клинических испытаний. В этой статье мы обращаем внимание на относительные достоинства и недостатки нейробиоуправления в контексте современных технологий визуализации. Мы обсудим, как новые формы сканирования мозга могут обеспечить будущие направления, чтобы наметить значимые исследования для возможного включения в клинический арсенал.
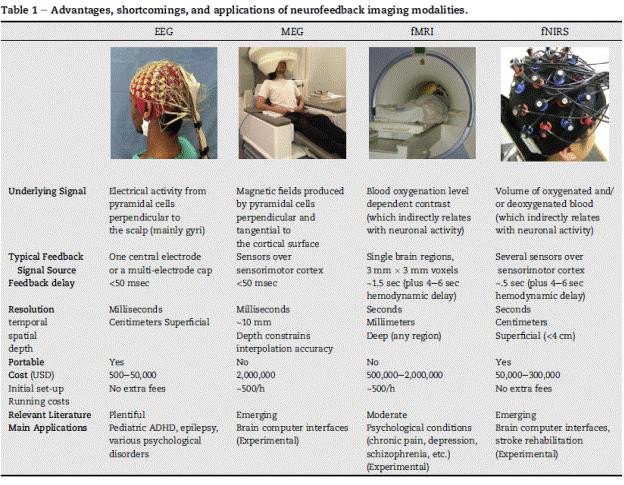
Эволюционное производное от биоуправления с обратной связью (БОС), в 1960-е годы появилось нейробиоуправление, применяющее нервную обратную связь с помощью ЭЭГ (Kamiya, 2011). До сегодняшнего дня, специализированные клиники и частные учреждения продолжают предлагать вариации ЭЭГ нейробиоуправления (EEG-NF) для множества заболеваний и нарушений, хотя это вмешательство многими отвергается как плацебо-подобное (смотрите следующий раздел). Вслед за EEG-NF, открытие новых технологий для визуализации живого человеческого мозга значительно расширило сферу нейробиоуправления, которая сегодня включает в себя более новые методы, такие, как метод функциональной магнитно-резонансной томографии (functional magnetic resonance imaging –fMRI, фМРТ), метод функциональной ближне-инфракрасной спектроскопии (functional near infrared spectroscopy -fNIRS, фБИС) и метод магнитоэнцефалографии (МЭГ) (таблица 1).
Таким образом, современное нейробиоуправление опирается на разнообразные методы визуализации, чтобы иметь возможность вести волевой контроль над электромагнитными и гемодинамическими изменениями в мозговой деятельности (Cannon, 2015; Hammond, 2011; Thibault, Lifshitz, Birbaumer, & Raz, 2015). В рамках каждого метода визуализации, кроме того, исследователями были разработаны четкие протоколы нейробиоуправления, которые нацелены на различные сигналы мозга и их сопутствующие физиологические процессы (Hammond, 2011;. Sulzer, Haller и др, 2013). В то время как сторонники нейробиоуправления иногда сваливают вместе эти разнообразные протоколы, результаты исследований поддерживают некоторые методы визуализации больше, чем другие. В этой статье мы обсудим потенциальные достоинства и недостатки современных методов нейробиоуправления и обозначим их место в текущем технологическом ландшафте.
2. ЭЭГ нейробиоуправление
Более полувека назад нейробиоуправление пришло на сцену, способствуя тому, чтобы основная неинвазивная технология того времени, ЭЭГ, могла считывать "образ" живого человеческого мозга. Хотя ЭЭГ-НФ по-прежнему сохраняет некоторую привлекательность в качестве альтернативы обычным средствам медицинского лечения, имеющиеся доказательства подвергают сомнению клиническое превосходство тренировок с обратной связью по сравнению с контролем (Arnold et al., 2013; Esmail & Linden, 2014; Lansbergen et al., 2011; Lofthouse, Arnold, Hersch, Hurt, & DeBeus, 2012; Logeman, Lansbergen, van Os, Bocker, & Kenemans, 2010; Perreau,-Linck, Lessard, L_evesque, & Beauregard, 2010; Sonuga-Barke et al., 2013; Thibault et al., 2015; Van Dongen-Boomsma, Vollebregt, Slaats-Willemse, & Buitelaar, 2013; Vollebregt, van Dongen-Boomsma, Buitelaar, & Slaats-Willemse, 2014; Zuberer, Brandeis, & Drechsler, 2015). Тем не менее, ЭЭГ-НФ остается относительно активной клинической сферой и может похвастаться международным признанием, специализированными научными журналами и более тысячью практикующих специалистов (Thibault et al., 2015).
В то время как сторонники ЭЭГ-НФ претендуют на его способность эффективно лечить ряд психологических и неврологических расстройств (Arns, Heinrich, & Strehl, 2014; Cannon, 2015; Hammond, 2011; Tan et al., 2009), по-видимому, для этого имеются и другие влияния, чем обратная связь сама по себе, которые приводят к улучшению клинических исходов по целому ряду расстройств (Тибо и др., 2015). Например, в наиболее проработанном приложении ЭЭГ-НФ для лечения дефицита внимания с гиперактивностью (СДВГ) все исследования, выполненные двойным слепым (Arnold et al., 2013; Lansbergen et al., 2011; Vollebregt et al., 2014) и несколько с одинарным слепым (Perreau-Linck et al., 2010; Van Dongen-Boomsma et al., 2013) контролем, демонстрируют сопоставимые клинические исходы в случаях настоящей обратной связи и при имитации обратной связи. Эти исследования часто сравнивают "релевантную" информацию - т.е., подлинное ЭЭГ-РФ - с обратной связью от несвязанных сигналов мозга, например, от нейронной активности мозга другого участника (Вставка 1 изображает некоторые уместные идеи и терминологию). Следует отметить, что двойные слепые контролируемые исследования, являющиеся золотым стандартом в клинической и научно-исследовательской области, почти отсутствуют в клинической ЭЭГ-НФ, за исключением экспериментов с СДВГ.
Вставка 1. Важная терминология.
|
Истинная обратная связь: Обратная связь от региона или частоты ЭЭГ, представляющей интерес (например, от исследуемой области мозга или ЭЭГ ритма), полученная непосредственно от мозговой активности пациента. |
Фальшивая (sham) обратная связь: Обратная связь не является производной от мозговой деятельности пациента, или обратная связь происходит от мозга участника, но не от региона или частоты, которые представляют интерес. Исследователи иногда используют случайную обратную связь или обратную связь, полученную в предыдущем обследовании того же или другого участника. |
Специфическое лечение / Специфичность: Методы лечения, которые работают в результате точного, назначенного механизма действия. |
Неспецифические факторы: факторы, которые способствуют изменениям после лечения, но не являются результатом назначенного механизма действия. Они могут включать в себя, но не ограничиваясь этим, спонтанную ремиссию и позитивные ожидания. |
Специфичность подкрепления: Когда конкретное поведение или исход приводит к специфическому вознаграждению. Изменение или введение обратного подкрепления при сохранении при этом всех остальных элементов эксперимента является эффективным способом тестирования специфичности лечения. |
Ряд обзоров и мета-анализов посвящены EEG-НФ лечению СДВГ (Arns et al., 2014; Arns, Ridder, & Strehl, 2009; Lofthouse et al., 2012; Sonuga-Barke et al., 2013), эпилепсии (Tan и др., 2009), депрессии и тревоги (Hammond, 2005), болезни Паркинсона (Esmail & Linden, 2014), а также множества других расстройств (Hammond, 2011). Некоторые из этих работ отмечают недостаток убедительных доказательств (Esmail & Linden, 2014; Lofthouse и др 2012. Sonuga-Барке и др., 2013), тогда как другие указывают на наличие лишь одинарного слепого контроля, нерегулярности контрольных групп, отсутствие достаточного рецензирования публикаций (См. Thibault et al., 2015для получения дополнительной информации). Положительным исключением является одно исследование, выполненное двойным слепым методом с фиктивным контролем, в котором большее клиническое улучшение отмечено у пациентов, перенесших инсульт, при истинной, а не мнимой обратной связи (Ramos-Murguialday и др., 2013). Такое положение дел свидетельствует о том, что преимущества EEG-НФ для СДВГ в значительной степени зависят от факторов, связанных с контекстными параметрами, а не условной обратной связи как таковой (Beyerstein, 1990; Thibault et al., 2015). Нехватка надежных данных не позволяет делать выводы относительно клинической эффективности EEG-НФ для лечения эпилепсии, депрессии, беспокойства, наркомании, болезни Паркинсона и реабилитации после инсульта.
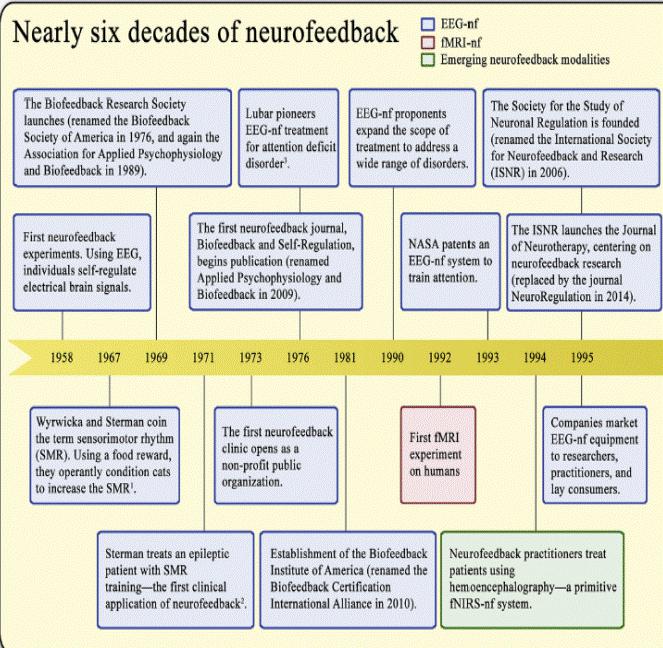
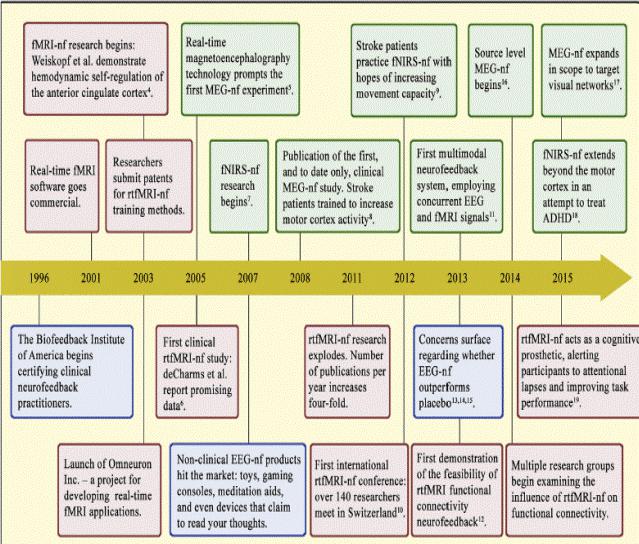
Временная шкала – история развития EEG-НФ с момента своего появления в конце 1950-х годов. Это визуальное представление захватывает разные организации, журналы и события, которые сформировали и развивали эту технику. В течение более чем 40 лет после первого эксперимента по нейробиоуправлению, в сфере EEG-НФ доминировали соответствующие дискуссии. В 2003 году появление экспериментов с ФМРТ спровоцировало новое поколение исследований. References:
1. (Wyrwicka & Sterman, 1968), 2. (Sterman & Friar, 1972), 3. (Lubar & Shouse, 1976),
4. (Weiskopf et al., 2003), 5. (Lal et al., 2005), 6. (deCharms et al., 2005)
7. (Sitaram, Zhang, et al., 2007), 8. (Buch et al., 2008),
9. (Mihara et al., 2012), 10. (Sulzer, Haller, et al., 2013),
11. (Zotev, Phillips, Young, et al., 2013; Zotev, Phillips, Yuan, et al., 2013),
12. (Arnold et al., 2013), 13. (Ogrim & Hestad, 2013), 14. (Vollebregt et al., 2014),
15. (Koush et al., 2013), 16. (Florin et al., 2014),
17. (Okazaki et al., 2015), 18. (Marx et al., 2015),
19. (DeBettencourt, Cohen, Lee, Norman, & Turk-Browne, 2015).
Некоторые сторонники EEG-НФ утверждают, что неспецифические факторы сами по себе не могут объяснить клинических улучшений, потому что изменения наблюдаются с помощью объективных измерений, включая электроэнцефалограмму (Leins et al., 2007; Strehl et al., 2006) и фМРТ (L_evesque, Beauregard, & Mensour, 2006; Ros et al., 2013). Тем не менее, лишь немногие, если таковые имеются, исследования исключают влияние других параметров, которые присущи обучению с обратной связью (Вставка 2 дает примеры). Более того, неспецифические факторы часто провоцируют весьма специфические изменения в поведении и нейронной активности (Raz & Михельс, 2007). Кроме того, многие эксперименты с нейробиоуправлением либо не используют контрольных групп или контроля управления, который существенно отличается от цели лечения (например, с точки зрения длины, интенсивности и режима обучение). Кроме того, EEG-НФ может содержать значительный плацебо компонент, потому что это стоит денег, требует десятки сессий, включает в себя лечебно-измерительные приборы и несет в себе привлекательность науки о мозге (Ali, Lifshitz, & Raz, 2014). Добавьте к этому акцент на когнитивные требования, которые часто направлены на улучшение психологических, а не физиологических состояний (Benedetti et al., 2003; Moseley et al., 2002; Waber, Shiv, Carmon, & Ariely, 2008), и многогранный характер нейробиоуправления становится очевидным: в то время как EEG-НФ изменяет как мозговые потенциалы, так и поведенческие показатели, текущие результаты строго поддерживают прямую связь между специфической обратной связью и наблюдаемыми изменениями.
Вставка 2. Плацебо.
Без поддельной (sham) контрольной группы исследователи не могут окончательно определить степень, в которой назначенный механизм отвечает за улучшение. Кроме того, поскольку нейрофидбэк включает в себя многие психосоциальные элементы, участники обучения с обратной связью могут быть особенно восприимчивы к неспецифическим факторам. За последнее десятилетие исследователям нейробиоуправления все чаще приходилось сталкиваться с этими скрытыми параметрами. Вот примеры: |
Характеристики спроса: В психологических экспериментах участники часто показывают улучшения, которые параллельны ожиданиям экспериментатора, особенно если они явным образом осведомлены о экспериментальных гипотезах (Nichols & Манер, 2008). |
Состояние лечения: При введении плацебо, пациенты с расстройствами, высоко поддающимися психологическим факторам, показывают большее улучшение, чем пациенты с расстройствами, которые менее поддаются психологическим факторам (Wampold, Минами, Тирни, Баскин, и Бхати, 2005). |
Взаимодействие с технологией: Лица переоценивают значимость передовой технологии (Ali и др., 2014), потенциально увеличивая мотивацию и улучшая ожидаемые результаты. |
Взаимодействие с практикующим врачом: Просто встреча с клиницистом может спровоцировать целебное действие (Margo, 1999). |
Цена: Дорогостоящее лечение более эффективно, чем менее дорогостоящие эквиваленты (Waber и др., 2008). |
Интенсивность: Более интенсивные медицинские процедуры производят большие эффекты плацебо (Kaptchuk и соавт., 2006). |
Возраст: Дети реагируют на плацебо больше, чем взрослые (Rheims, Cucherat, Arzimanoglou, & Ryvlin, 2008). |
3. ФМРТ
Разработанное на основе фМРТ, реально-временное функциональное МРТ нейробиоуправление (RtfMRI-НФ) представляет собой неинвазивный метод для модуляции региональной нейронной активности. Метод rtfMRI обеспечивает сбор, обработку и визуализацию зависимых от уровня кислорода в крови (blood oxygen level-dependent -BOLD) данных ФМРТ в пределах короткой задержки (например, 1E2 сек; Вайскопф, 2012). Из-за этого почти одновременно действующего цикла сбора-обработки-отображения, rtfMRI-НФ обучение позволяет людям видеть и саморегулировать сигналы ФМРТ от своего собственного мозга. В отличие от другой разновидности – ЭЭГ-НФ, rtfMRI-НФ обучение пригодно для получения точной локализации и модуляции активности соответствующих структур головного мозга (deCharms, 2008).
Принимая во внимание, что EEG-НФ требует много сеансов, чтобы изменить электрическую активность, с помощью rtfMRI-Н.Ф. испытуемые могут избирательно модифицировать ФМРТ BOLD сигнал в течение 30 минут обучения и иногда даже раньше (Bru¨ hl et al., 2014; Canterberry et al., 2013; Greer, Trujillo, Glover, & Knutson, 2014; Gr€one et al., 2015; Hui, Zhang, Ge, Yao, & Long, 2014; Lawrence et al., 2014; Paret et al., 2014; Sulzer, Sitaram, et al., 2013; Zhang, Yao, Zhang, Long, & Zhao, 2013; Zhang, Zhang, et al., 2013). Эта поразительная разница между EEG-РФ и rtfMRI-РФ заслуживает дальнейшего обсуждения. Обучение на основе нейро-гемодинамики может происходят более быстро, так как в отличие от отсутствия мозговых рецепторов для обнаружения электрических изменений, барорецепторы постоянно информируют центральную нервную систему о текущем объеме крови (Birbaumer, 2011). Некоторые данные на животных (например, крыс) относительно активации барорецепторов свидетельствуют в пользу этого спекулятивного предположения (Dworkin, 1988). Однако, независимо от гипотетических взглядов в отношении возможных механизмов, лежащих в основе метода, люди, кажется, способны модулировать нейронную гемодинамику быстрее, чем они это делают с мозговыми электрическими колебаниями. Уже один этот факт делает rtfMRI-НФ привлекательным инструментом исследований.
Использование rtfMRI-РФ позволяет проводить более фокальные исследования высших (например, когнитивно-поведенческих) функций мозга и нейропластичности (deCharms и др., 2004; Weiskopf и др., 2007). Например, здоровые люди продемонстрировали способность к самостоятельной регуляции активности головного мозга в нейроанатомических структурах, которые зачастую связаны с аффектом, например, инсула, миндалина, префронтальная кора и передняя поясная кора (Hamilton, Glover, Hsu, Johnson, & Gotlib, 2011; Johnston et al., 2011; Posse et al., 2003; Sitaram, Caria, et al., 2007; Zotev et al., 2011). Эти данные указывают на rtfMRI-НФ как на потенциально эффективное вмешательство для нескольких клинических областей, включая регулирование боли (например, deCharms и др., 2005), шума в ушах (Haller, Birbaumer, & Veit, 2010), болезни Паркинсона (Subramanian et al., 2011) и депрессии (Linden et al., 2012; Young et al., 2014). Хотя эти клинические исследования представляют собой пока только нарождающиеся усилия и, как правило, опираются на выборки малых размеров и без повторных анализов, формирующееся направление из этих предварительных результатов говорит о выгодных чертах клинического потенциала rtfMRI-HФ. Тем не менее, тщательная оценка литературы позволяет выделить несколько предостережений для подавления этой растущей уверенности.
Одно из первых и наиболее заметных rtfMRI-НФ исследований реализовало тщательную схему и сообщило о надежных результатах, что впоследствии вызвало значительный энтузиазм (DeCharms и др., 2005). Это исследование показало, что люди, страдающие от хронической боли и получившие лечение rtfMRI-НФ, научились модулировать нейронную активность в ростральном anterior cingulated cortex (ACC). Кроме того, эти лица были способны впоследствии управлять активностью ACC даже без обратной связи, в результате чего достигалось желаемое уменьшение субъективной боли. Поскольку эти эффекты отсутствовали у контрольной группы, этот ключевой отчет представил важные доказательства в поддержку rtfMRI-HФ. Однако, энтузиазм превратился в скептицизм после того, как в результате нескольких независимых усилий по репликации данных, в том числе первоначальных авторов, не удалось подтвердить заявленные результаты (Birbaumer, Ruiz, & Sitaram, 2013; Sulzer, Haller, et al., 2013).
Одно последующее исследование включало 59 пациентов с хронической болью, а не 12 пациентов в первоначальном исследовании, и обнаружило, что, в то время как только те, которые получали истинную обратную связь, освоили контроль над нейронной активностью, болевые рейтинги в равной степени уменьшились у экспериментальных и контрольных пациентов (Sulzer, Галлер и др., 2013). Неспособность повторить первоначальные выводы может быть обусловлена завышенной вероятностью ложных срабатываний при использовании небольшой выборки, т.е. общим слабым местом всех нейронаук (Button et al., 2013). Кроме того, некоторые эксперты по Neurofeedback отметили, что в попытке репликации, исследователи предоставляют участникам с истинной обратной связью и в контроле одни и те же стратегии обучения, которые были сформированы и оптимизированы в ходе предыдущих экспериментов по нейробиоуправлению (Sulzer, Haller, et al., 2013). Таким образом, эта попытка репликации показывает, что эффективная умственная стратегия может дать сопоставимые эффекты независимо от того, обучается ли человек через нейробиоуправление или через словесную инструкцию (Sulzer, Haller, et al., 2013). Вклад этого ключевого эксперимента, следовательно, в значительной степени был очищен от обещаний, которые он первоначально возвестил.
Большинство rtfMRI-НФ отчетов редко описывают изменения в поведении; вместо этого, они сообщают о доказательных концептуальных экспериментах, демонстрируя, что участники могут изменять поток крови в избранных корковых регионах. Из более 70 опубликованных rtfMRI-НФ исследований, очень немногие сообщили, что участникам не удалось модулировать мозговую гемодинамику (Berman, Horovitz, Venkataraman, & Hallett, 2011; Hampson et al., 2011). Используя имитацию обратной связи в качестве контроля, другие rtfMRI-НФ эксперименты показали, что участники увеличили свою способность модулировать определенные мозговые регионы посредством обучения (Caria et al., 2007; Caria, Sitaram, Veit, Begliomini, & Birbaumer, 2010; Chiew, Laconte, & Graham, 2012; Hui et al., 2014; Lawrence et al., 2014; McCaig, Dixon, Keramatian, Liu, & Christoff, 2011; Rota et al., 2009; Rota, Handjaras, Sitaram, Birbaumer, & Dogil, 2011; Yoo, Lee, O'Leary, Panych, & Jolesz, 2008; Young et al., 2014; Zotev, Phillips, Young, Drevets, & Bodurka, 2013; Zotev et al., 2011). Во многих других исследованиях часто не хватало необходимого контроля или соответствующего анализа, чтобы определить, что истинное нейробиоуправление было основным фактором, обусловливающим наблюдаемые мозговые изменения (Thibault и др. 2015); Рис. 3 изображает некоторые общие условия контроля.
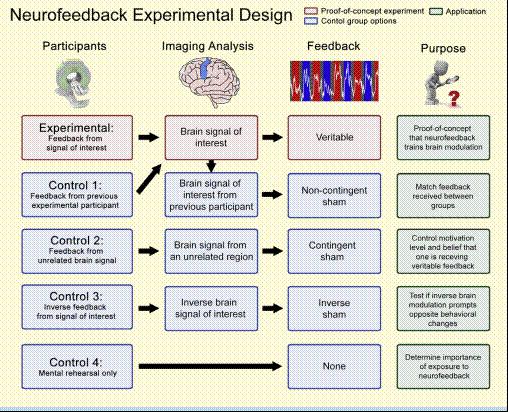
Рис. 3. Надежные экспериментальные проекты могут лучше разделять друг от друга эффекты истинного нейробиоуправления и выяснять лежащие в основе приводные механизмы нервной регуляции и изменения поведения. Эта схема изображает формат многих доказательных исследований (красный), одновременно подчеркивая некоторые из наиболее распространенных условий контроля (синий) и их родственных разновидностей (зеленый). В наиболее строгих исследованиях по нейробиоуправлению используются несколько контрольных групп.
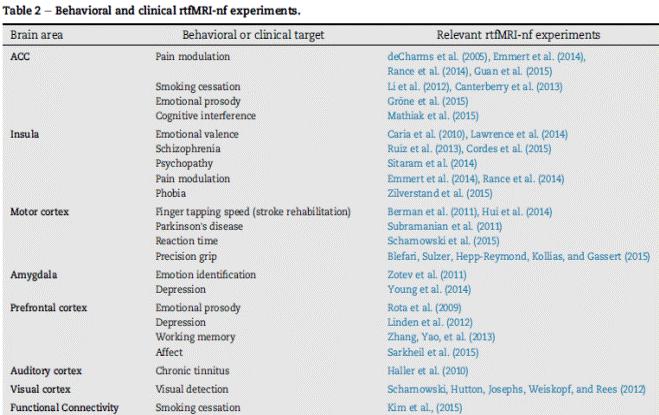
Таким образом, эти коллективные результаты вызывают некоторые опасения по поводу специфики нейробиоуправления, мнимого или настоящего. В качестве примера, недавнее исследование показало, что у участников, получающих фиктивное нейробиоуправление, обнаруживается увеличение активизации двустороннего островка, ACC, моторных зон и префронтальной области (Ninaus и др., 2013), т.е. четырех наиболее общих регионах, обученных с помощью rtfMRI-НФ (таблица 2). Экспериментальные схемы, в которых отсутствует контроль без обратной связи или фиктивной обратной связи, не могут различить, обусловлено ли изменение от базовой линии обратной связью или такими факторами, как ментальная стратегия и внимание и мотивация, которые приходят через участие в предшествующих экспериментах. Таким образом, хорошо контролируемых конструкций катастрофически не хватает, хотя и отчаянно необходимо, чтобы отграничивать друг от друга конкретные преимущества rtfMRI-НФ.
Роль "ментальной стратегии" и "устойчивости эффекта" остаются критическими лакунами в понимании rtfMRI-НФ. Ментальная стратегия - когнитивная схема, по которой субъект следует для достижения желанной цели - частично отвечает за быстрые изменения в BOLD сигнала фМРТ. Например, в авторитетном обзоре (Sulzer, Галлер и др., 2013) показано, что участники, которые получили четкие инструкции по психической стратегии, в сравнении с лицами, формирующими стратегию сами, были более успешными в саморегулировании. Более того, сравнение настоящей обратной связи с отсутствием обратной связи (Zhang, Yao, et al., 2013; Zhang, Zhang, et al., 2013), инвертированной обратной связью (Sulzer, Sitaram, et al., 2013) или обратной связью от различных регионов мозга (Paret и др., 2014), показало аналогичные нейронные изменения по сравнению с исходным (в первом испытании) в экспериментальных и контрольных группах. С другой стороны, результаты на человеке и животных позволяют предположить, что явно заданные методы не нужны и что условная обратная связь несет ответственность за нервную регуляцию (Caria et al., 2010; Koralek, Jin, Long, Costa, & Carmena, 2012). Таким образом, степень, в которой явные психические стратегии относятся к обучению навыкам модуляции мозга, остается неясным.
В некоторых экспериментах минимальный уровень обучения может помочь участникам избежать вредных стратегий. Например, так как и негативные, так и положительные эмоции стимулируют активацию миндалины (Garavan, Pendergrass, Ross, Stein, & Risinger, 2001; Hamann, Ely, Hoffman, & Kilts, 2002; Yang et al., 2002), некоторые экспериментаторы заботятся, чтобы инструктировать участников принимать позитивные умственные стратегии (Young et al., 2014; Zotev, Phillips, Young, et al., 2013). Аналогичные соображения относятся к повышающей регуляции передней инсулы, которая реагирует на сильные отрицательные воздействия (Phillips и др, 1997;. Wicker и др., 2003), а также к изменениям активности АСС, которая относится к широкому спектру познавательных процессов (Bush, Luu, & Posner, 2000; Etkin, Egner, & Kalisch, 2011). Потенциал неадекватных психических стратегий может доставлять меньше беспокойства для протоколов, направленных на изменение сенсомоторных областей через воображаемые движения.
Устойчивость относится к периоду времени после того, как обратная связь закончилась, в ходе которого участники могут продемонстрировать выученные преимущества rtfMRI-НФ. Как выясняется, только в нескольких исследованиях изучена устойчивость нейробиоуправления (Thibault et al., 2015). В то время как некоторые эксперименты показывают, что участники сохраняют контроль над целевыми областями мозга (Caria et al., 2007; Mathiak et al., 2015; Robineau et al., 2014; Scharnowski et al., 2015; Zotev, Phillips, Young, et al., 2013; Zotev, Phillips, Yuan, Misaki, & Bodurka, 2013; Zotev et al., 2011), другие исследования сообщают об отсутствии такого удержания (Berman, Horovitz, & Hallett, 2013; Greer et al., 2014; Hamilton et al., 2011; Ruiz et al., 2013; Sulzer, Sitaram, et al., 2013). Таким образом, головоломка о психических стратегиях и устойчивости навыков по-прежнему требуют разрешения.
Относительно небольшое число отчетов коррелируют rtfMRI-НФ обучение с изменениями в восприятии или любом поведении (таблица 2). Например, имеется два сообщения о том, что волевое демпфирование ACC активности снижает тягу к сигаретам (Canterberry et al., 2013; Li et al., 2012); Тем не менее, оба эксперимента характеризуются дефицитными схемами, что затрудняет определиние того, обратная связь или умственная стратегия на самом деле ответственны за уменьшение желания курить (Thibault et al., 2015). Другой пример касается обезболивания: в то время как одно исследование продемонстрировало, что модуляция активности ACC происходила независимо от поведенческих параметров, таких, как воспринимаемая интенсивность боли (Rance, Ruttorf, Nees, Rudi Schad, & Flor, 2014), другое исследование показало, что контроль за деятельностью АСС и передней инсулы уменьшает восприятие боли (Emmert et al., 2014). В соответствии с некоторыми исследованиями, модуляция активности в инсуле, по-видимому, влияет на воспринимаемую валентность эмоциональных раздражителей (Caria et al., 2010; Ruiz et al., 2013); еще одно из этих исследований не имело никакого контроля (Ruiz и др., 2013) и еще один эксперимент показал, что контроль за деятельностью в области островка вряд ли связан с валентностью (Lawrence et al., 2014).
Кроме АСС и инсулы, обучение моторных областей может улучшать моторный контроль как у здоровых участников (Hui и др., 2014), так и при болезни Паркинсона (Subramanian et al., 2011). Однако в первом случае контрольная группа также демонстрировала улучшение скорости пальцевого теппинга, в то время как в последнем эксперименте не использовано никакого контроля с фиктивной обратной связью. Изменяя ток крови в префронтальной области, можно улучшить обнаружение эмоциональных просодических интонаций (Rota и др., 2009) и словесную оперативную память (Zhang, Yao, et al., 2013). Однако, опять же, последний эксперимент показал, что фиктивное нейробиоуправление повышает производительность в 4 из 5 задач на оперативную память, даже при ухудшении способности участников модулировать целевые участки мозга. С другой стороны, контроль над мозговой активностью в миндалине, как представляется, опирается на эмоциональные аспекты. Sham-контролируемые эксперименты показали, что успешная модуляция амигдалы уменьшает тревогу и повышает уровень счастья у пациентов с депрессией (Young et al., 2014) и отрицательно коррелирует с трудностью определения чувств и восприимчивостью к гневу других у здоровых участников (Zotev et al., 2011). Хотя нейробиоуправление может определять некоторые из этих результатов, только экспериментальные образцы, показывающие более надежные контроли, позволят констатировать такую специфику (Рис. 2). Таким образом, в конце концов, в литературе имеется смешанный ряд сведений с небольшим числом убедительных доказательств.
Недавние исследования принесли все больше указаний о важности функциональных связей в эффектах rtfMRI- НФ (Emmert et al., 2014; Fukuda, Mitsuo, & Hiroshi, 2015; Greer et al., 2014; Kim, Yoo, Tegethoff, Meinlshmidt, & Lee, 2015; Sarkheil et al., 2015; Shen, Zhang, Yao, & Zhao, 2015; Sitaram et al., 2014; Zhang, Yao, Shen, Yang, & Zhao, 2014). В одном исследовании сообщалось о взаимодействии между функциональными связями, rtfMRI-НФ и поведением (Hui и др., 2014). По сравнению с контрольной группой с фиктивной обратной связью, истинное нейробиоуправление изменяло связи мозга у экспериментальной группы: они улучшили свою способность модулировать премоторную кору и увеличивать скорость нажатия пальцем (Hui и др., 2014). Тем не менее, выводы из других исследований по функциональным взаимосвязям при нейробиоуправлении были менее убедительными. Два анализа продемонстрировали после обучения изменения функциональной связности у участников, получающих только настоящую обратную связь, но экспериментальная и контрольные группы продемонстрировали аналогичные улучшения поведенческих показателей (Sarkheil и др 2015; Shen и др, 2015). Таким образом, можно предположить, что анализ функциональной связности едва ли может объяснить взаимодействие нейробиоуправления с изменением в поведении. Если будущие эксперименты установят и закрепят эти отношения, прибегая к анализу функциональной связности, это поможет распутать клубок нейронных механизмов, содействующих саморегулированию.
4. functional Near Infrared Spectroscopy -fNIRS
Инновационная функциональная технология нейровизуализации, fNIRS является относительно неинвазивным, безопасным и доступным способом мониторинга активности мозга (Ferrari & Quaresima, 2012). fNIRS технология обычно использует портативный колпачок с примерно 50 каналами для измерения концентрации венозной крови в поверхностных областях мозга. В то время как fNIRS зондирует ту же гемодинамику, как и фМРТ (Cui, Bray, Bryant, Glover, & Reiss, 2011), каждый метод имеет различные сильные и слабые стороны при применении к нейробиоуправлению. С одной стороны, fNIRS является относительно недорогим, устойчивым к артефактам движения и портативным методом. С другой стороны, в то время как fNIRS предполагает пространственное разрешение порядка сантиметров на поверхности коры, ФМРТ обеспечивает миллиметровую точность на протяжении всего мозга (Таблица 1 содержит более подробное сравнение).
Эксперименты с fNIRS-НФ, как правило, имеют целью продемонстровать увеличенный контроль в моторных регионах, ставя задачу участникам представить себе постукивание пальцами или сжав руки. Четыре исследования сообщили, что fNIRS-НФ увеличивает активность в различных двигательных областях коры (Kanoh, Susila, & Miyamoto, 2011; Kober et al., 2014; Mihara et al., 2012, 2013). Тем не менее, просто перемещая конечности или скрытно напрягая мышцу можно также модулировать активность моторной коры, и исследователи редко измеряют сигналы электромиографии (EMG), чтобы обнаружить такое скрытое напряжение мышц. Таким образом, тонкая, возможно, подсознательная, мышечная активность может отвечать за наблюдаемое увеличение нейронной функции. Приверженцы fNIRS утверждают, что в этом методе контингентная обратная связь кажется ключом: модули мозга изменяют активность как функция подлинной, но не мнимой, обратной связи (Kober et al., 2014; Mihara et al., 2013). Тем не менее, настоящая обратная связь может научить участников, возможно, невольно и без осознания, повышению мышечного напряжения без формирования новых ментальных стратегий. Таким образом, fNIRS-НФ моторной коры может, в некотором скрытом смысле, действовать как форма ЭМГ-биоуправления.
Помимо улучшения моторного контроля, одно fNIRS-НФ исследование сообщает об успешном регулирования префронтальной нейронной активности при лечении СДВГ (Marx et al., 2015). Однако, в то время как участники, которые получили fNIRS-НФ, улучшили различные показатели СДВГ, сопоставимые показатели были получены у участников, которые получили EEG-НФ и ЭМГ-биоуправление. Кроме того, Marx et al.. (2015) уклоняются от ответа на вопрос, научились ли участники регулировать fNIRS сигнал. Таким образом, связь между улучшением симптоматики и fNIRS-НФ остается шаткой.
5. MEG
МЭГ является методом визуализации, который измеряет амплитуду магнитных сигналов, излучаемых с поверхностных и более глубоких кортикальных областей. Для записи такой активности, как правило, участники сидят в магнитно-экранированной комнате при размещении на их голове внутри шлема сотни магнитометров - датчиков, способных обнаружить небольшие изменения в магнитном поле. Поскольку такая специальная аппаратура требует дорогостоящей настройки и существенной поддержки, MEG-НФ во многом остается прерогативой исследователей мозга в передовых центрах обработки изображений. Как и ЭЭГ, МЭГ также обеспечивает прямое, а не косвенное (как, например, в случае с fМRI и fNIRS) измерение нейронной активности. Однако, в отличие от электрических сигналов, череп и ткани едва ли искажают магнитное поле, таким образом, позволяя магнитометрам точно измерить минутные изменения в нервной деятельности. Кроме того, по сравнению с другими методами визуализации, MEG дает впечатляющее пространственное разрешение и отношение сигнал-шум (в таблице 1 приводится подробное сравнение).
Здоровые участники, использующие Meg-НФ, обучаются двунаправленному контролю нейронной активности диапазона 9-15 Гц в двигательной области коры головного мозга (его часто называют sensorimotor- или м-ритм) в течение 64 мин (Mellinger et al., 2007), а для нейронных источников, участвующих в воображении движений – после восьми сессий по 12-18 мин (Florin, Bock, & Baillet, 2014). Тем не менее, как и в случае fNIRS-НФ, здесь участники могут неосознанно полагаться на мышцы конечностей для увеличения корковой активации. Эта опция получает дальнейшее подтверждение в результатах от пациентов, перенесших инсульт, у которых проявляется нарушение мышечного контроля и которым требуется намного больше – от 13 до 22 сессий длительностью 1-2 часа – для управления сигналами MEG (Buch et al., 2008). К тому же, с одним исключением (Gallegos-Ayala et al., 2014), пациенты, у которых отсутствует мышечный контроль (например, полностью парализованные пациенты) оказываются полностью неудачными попытки в сохранении контроля над сигналами нейровизуализации (De Massari и др., 2013). Поэтому не нейробиоуправление, а напряжение мышц - возможно, вопреки общим представлениям - может приводить к таким улучшениям.
Два недавних MEG-НФ исследования включали поведенческие показатели и использовали условия отсутствия обратной связи (Boe et al., 2014) и sham обратную связь (Okazaki et al., 2015) в качестве контроля. Первое исследование показало, что только участники с истинной обратной связью обучались повышать уровень активности источника из первичной сенсомоторной кора в трех 40-минутных сессиях (Boe et al., 2014). Этот эксперимент включал датчики EMG, размещенные на сгибательных и разгибательных мышцах пальцев - уменьшая, но не полностью устраняя потенциалы сокращения мышц от телесных источников. Интересно, что у контрольной и экспериментальной групп одинаково улучшилась ловкость пальцев при выполнении единственной исследуемой поведенческой задачи. В другом эксперименте разделили участников на две группы, и половине каждой группы предъявляли имитацию обратной связи (Okazaki et al., 2015). В ходе одного 10 минутного сеанса обратной связи, одна группа пыталась увеличить выраженность задней альфа латерализации влево, в то время как другая группа была нацелена на латерализацию той же активность вправо. Одной экспериментальной группе удалось повысить альфа латерализацию, и она проявила связанное ухудшение порога зрительного обнаружения. Данный эксперимент сообщил об отсутствии дополнительных прогнозируемых изменений в головном мозге и поведении и едва ли свидетельствует о пользе MEG-НФ. Таким образом, в то время как ранние исследования MEG, возможно, и вызвали ожидания по поводу новых клинических перспектив, требуется больше экспериментов для тщательного контроля вышеупомянутых предостережений, чтобы проверить эффективность MEG-НФ в качестве жизнеспособной методики для модификации мозга и поведения.
6. Future steps
Охват методов нейробиоуправления значительно расширился с появлением новых методов визуализации в реальном масштабе времени. Как мы уже говорили, однако, влияние нейробиоуправления на поведение во многом остается неопределенным. Функциональная связность в настоящее время пронизывает литературу по Neurofeedback, поскольку мультимодальная визуализация находится на переднем крае (Zotev, Phillips, Young, et al., 2013; Zotev, Phillips, Yuan, et al., 2013), и более сильные магнитные поля (например, МРТ сканеры работают на 7 Т) вновь разжигают энтузиазм среди исследователей (Grone et al., 2015). Ученые начинают распутывать загадки, как обучение обратной связи перестраивает нейронные цепи; они могут даже начать выяснение целесообразности одновременного регулирования по нескольким различным сигналам мозга. И все же, для нейробиоуправления мы должны установить клиническую значимость его предполагаемых терапевтических эффектов.
Сама по себе обратная связь, а не другие скрытые факторы, приводит в движение нейронные изменения – этот вопрос требует дальнейшего разъяснения. Экспериментов по нейробиоуправлению предостаточно, однако лишь немногие исследования расширяют эти усилия благодаря более надежным экспериментальным парадигмам. Для того, чтобы установить, отвечает ли конкретный сигнал нейробиоуправления за приобретенный навык модуляции мозга, обязательными являются условия контроля (на Рис. 2 показаны некоторые ключевые идеи). В дополнение к представлению контроля с имитацией обратной связи, исследователи должны быть направлены также на анализ менее очевидных факторов, определяющих различия между контрольной и экспериментальной группами. Например, некоторые практикующие специалисты по нейробиоуправлению утверждают, что положительная обратная связь, которую получают участники, оказывает влияние на результат тренировочных воздействий (Arns et al., 2014).
Предоставляя ложную обратную связь, основанную на активности мозга от ранее протестированных опытных участников, смогло бы контролировать уровень положительной обратной связи. Такие контрольные участники, однако, могут потерять мотивацию, если они испытывают отсутствие контроля за сигналом обратной связи и начинают верить, что они получают безусловную обратную связь. Многие клинические исследования подчеркивают, что большинство участников исследования могут правильно угадывать групповые задания (т.е. экспериментальная группа против плацебо; Shapiro & Shapiro, 1997). В некоторых случаях, кроме того, положительный исход зависит в большей степени от веры в истинное лечение, чем от фактического проводимого лечения (Dar, Stronguin, & Эттер, 2005). Предоставление второй контрольной группы с обратной связью от другой области их мозга может помочь уравнять убеждение, что они получают истинную обратную связь от интересующей нас области. Для подтверждения эффективности контрольных групп, исследователи могут собирать феноменологические анализы, в том числе о чувстве контроля над сигналом, мотивации и сущности группового задания. Более того, двойные слепые конструкции, где и исследователь и участники не знают о назначении групп, может устранить любые потенциальные влияния, которые экспериментаторы могут неосознанно оказывать на участников (и наоборот). Такие экспериментальные проекты обладают потенциалом для доверия к нейробиоуправлению при проверке и подтверждении принципа действия, разгадывая, какие скрытые факторы, такие, как мысленная стратегия и участие в нейробиоуправлении, могут внести свой вклад в нейронное саморегулирование.
В то время как более строгий контроль, вероятно, поможет пролить свет на предполагаемую связь между нейробиоуправлением и модуляцией мозга, дополнительные условия будет способствовать установлению линии обратной связи между обучением и поведенческими изменениями. Например, сторонникам нейробиоуправления надлежало бы изучать клинические популяции и измерять их поведение. В таких экспериментах исследователи могут предоставить некоторым участникам обратно пропорциональную обратную связь [т.е. давая положительную обратную связь контрольным участникам для модуляции того же целевого сигнала, как в экспериментальной группе, но в противоположном направлении, таким образом реверсируя случайное вознаграждение (вставка 1)]. Если обратно-контролируемые и экспериментальные участники учатся модулировать сигналы мозга в противоположных направлениях, проявляя противоположные поведенческие изменения, эти данные помогут выявить связь между нейробиоуправлением, мозговой саморегуляцией и поведением.
Экспериментальные схемы, использующие группы фиктивного контроля, представляют исследователям с некоторые этические головоломки - от отказа от эффективного лечения до участия в потенциально опасных процедурах. Нейробиоуправление, однако, до сих пор не накопило доверия "доказательной медицины" (Sulzer, Haller, et al., 2013; Thibault et al., 2015). Таким образом, использование фиктивных контролей может быть воспринято как утаивание эффективного лечения. Более того, исследователи, использующие фиктивный контроль, могут предъявлять надлежащее нейробиоуправление всем участникам, после завершения всего эксперимента, чтобы убедиться, что все в конечном итоге получили истинное лечение - как это принято во многих клинических испытаниях.
Реализация инвертированной обратной связи может показаться неэтичной потому, что она теоретически может ухудшить симптомы или ухудшить поведение. И все же, литература по нейробиоуправлению мало поддерживает эти опасения. Несколько ранних EEG-НФ экспериментов использовали инвертированные контроли у трудноизлечимых эпилептиков (Lubar et al., 1981; Sterman & MacDonald, 1978) и нашли сравнимое уменьшение частоты приступов после истинной и инвертированной обратной связи (Thibault et al., 2015). Что касается rtfMRI-НФ, только одно исследование использовало инвертированную обратную связь, и авторы не сообщают о каких-либо неблагоприятных эффектах (Sulzer, Sitaram, et al., 2013). Интересно, что можно найти много случаев различных протоколов с регулированием в противоположных направлениях. Например, во многих экспериментах участников обучали регулировать вверх активность передней инсулы (Caria et al., 2010; Lawrence et al., 2014; Ruiz et al., 2013; Sitaram et al., 2014), в то время как другие исследования поощряли деактивацию, чтобы уменьшить восприятие боли (Emmert et al., 2014; Rance et al., 2014) или устранить фобию (Zilverstand, Sorger, Sarkheil, & Goebel, 2015). Аналогично, множественные эксперименты обучали понижающей регуляции АСС для смягчения боли (deCharms et al., 2005; Guan et al., 2015) или снижения тяги к сигаретам(Canterberry et al., 2013; Li et al., 2012), в то время как другие поощряют ACC активность для повышения валентных рейтингов (Grone et al., 2015) или ограничения последствий когнитивной интерференции (Mathiak и др., 2010). Таким образом, исследователи уже используют регулирование в противоположнвх направлениях, но уклоняются от прямого сравнения поведенческих эффектов повышающей или понижающей регуляции конкретной активности мозга. На сегодняшний день, известны негативные последствия rtfMRI-НФ при умственной усталости и физического дискомфорта, типичного для условий визуализации мозга (Hawkinson et al., 2012; Sulzer, Haller, et al., 2013). При отсутствии неблагоприятных реакций, таким образом, этические аргументы против использования инвертированных контролей остаются слабыми.
Если хорошо контролируемые исследования укрепляют связь между обратной связью, активностью мозга и поведением, последующие исследования могли бы изучить возможность внедрения таких методов. Современная литература по нейробиоуправлению, однако, в значительной степени уклоняется от обязательства следовать осмотрительным экспериментальным конструкциям.
7. Conclusion
Нейробиоуправление в моде. Несмотря на энергичное возрождение на протяжении последнего десятилетия, недавние отчеты выдвигают на первый план множество методологических и интерпретационных предостережений, которые пронизывают соответствующую научную литературу. Хотя нейробиоуправление опирается на разнообразные методы визуализации, рудиментарные вопросы относительно ключевых концепций, таких, как устойчивость и специфичность, по-прежнему остаются нерешенными. В то время как нейробиоуправление, как представляется, помогает некоторым участникам освоить навык модуляции мозговой активности, относительный вклад специфической обратной связи по сравнению с невыраженными скрытыми факторами остается неясным. К настоящему времени, разбросанные поведенческие показатели, недостаток длительных наблюдений и многие методологические оговорки не позволяют формально одобрить нейробиоуправление в качестве инструмента для клинического лечения. Хотя жюри все еще продолжает работу, дополнительные здравомыслящие эксперименты и более убедительные результаты будут иметь решающее значение для дальнейшей демонстрации соблазнительных, хотя и пока не подтвержденных, клинических перспектив нейробиоуправления.
R e f e r e n c e s
Ali, S., Lifshitz, M., & Raz, A. (2014). Empirical neuroenchantment: from reading minds to thinking critically. Frontiers in Human Neuroscience, 27(8), 357. http://dx.doi.org/10.3389/ fnhum.2014.00357.
Arnold, L. E., Lofthouse, N., Hersch, S., Pan, X., Hurt, E., Bates, B., et al. (2013). EEG neurofeedback for ADHD: double-blind shamcontrolled randomized pilot feasibility trial. Journal of Attention Disorders, 17(5), 410e419. http://dx.doi.org/10.1177/ 1087054712446173.
Arns, M., Heinrich, H., & Strehl, U. (2014). Evaluation of neurofeedback in ADHD: the long and winding road. Biological Psychology, 95, 108e115. http://dx.doi.org/10.1016/ j.biopsycho.2013.11.013.
Arns, M., De Ridder, S., & Strehl, U. (2009). Efficacy of neurofeedback treatment in ADHD: the effects on inattention, impulsivity and hyperactivity: a meta-analysis. Clinical EEG and Neuroscience, 40(3), 180e189.
Benedetti, F., Pollo, A., Lopiano, L., Lanotte, M., Vighetti, S., & Rainero, I. (2003). Conscious expectation and unconscious conditioning in analgesic, motor, and hormonal placebo/ nocebo responses. The Journal of Neuroscience, 23(10), 4315e4323.
Berman, B. D., Horovitz, S. G., & Hallett, M. (2013). Modulation of functionally localized right insular cortex activity using realtime fMRI-based neurofeedback. Frontiers in Human Neuroscience, 7, 1e11. ttp://dx.doi.org/10.3389/ fnhum.2013.00638.
Berman, B. D., Horovitz, S. G., Venkataraman, G., & Hallett, M. (2011). Self-modulation of primary motor cortex activity with motor and motor imagery tasks using real-time fMRI-based neurofeedback. NeuroImage, 59, 917e925. http://dx.doi.org/ 10.1016/j.neuroimage.2011.07.035.
Beyerstein, B. L. (1990). Brainscams: neuromythologies of the new age. International Journal of Mental Health Systems, 19(3), 27e36. http://dx.doi.org/10.1186/1752-4458-3-7.
Birbaumer, N. (2011). The specificity of feedback. Retrieved August 3, 2015, from http://www.gocognitive.net/interviews/specificityfeedback.
Blefari, M. L., Sulzer, J., Hepp-Reymond, M.-C., Kollias, S., & Gassert, R. (2015). Improvement in precision grip force control with self-modulation of primary motor cortex during motor imagery. Frontiers in Behavioral Neuroscience, 9(February), 1e11. http://dx.doi.org/10.3389/fnbeh.2015.00018.
Boe, S., Gionfriddo, A., Kraeutner, S., Tremblay, A., Little, G., & Bardouille, T. (2014). Laterality of brain activity during motor imagery is modulated by the provision of source level neurofeedback. NeuroImage, 101, 159e167. http://dx.doi.org/ 10.1016/j.neuroimage.2014.06.066.
Bru¨ hl, A. B., Scherpiet, S., Sulzer, J., St€ampfli, P., Seifritz, E., & Herwig, U. (2014). Real-time neurofeedback using functional MRI could improve down-regulation of amygdala activity during emotional stimulation: a proof-of-concept study. Brain Topography, 27, 138e148. http://dx.doi.org/10.1007/s10548-013-0331-9.
Buch, E., Weber, C., Cohen, L. G., Braun, C., Dimyan, M. a, Ard, T., et al. (2008). Think to move: a neuromagnetic brain-computer interface (BCI) system for chronic stroke. Stroke; a Journal of Cerebral Circulation, 39(3), 910e917. http://dx.doi.org/10.1161/ STROKEAHA.107.505313.
Bush, G., Luu, P., & Posner, M. I. (2000). Cognitive and emotional influences in anterior cingulate cortex. Trends in Cognitive Sciences, 4(6), 215e222. http://dx.doi.org/10.1016/S1364-6613(00)01483-2.
Button, K. S., Ioannidis, J. P. A., Mokrysz, C., Nosek, B. A., Flint, J., Robinson, E. S. J., et al. (2013). Power failure: why small sample size undermines the reliability of neuroscience. Nature Reviews Neuroscience, 14(5), 365e376. http://dx.doi.org/10.1038/nrn3475.
Cannon, R. (2015). Editorial perspective: defining neurofeedback and its functional processes. NeuroRegulation, 2(2), 60e69. http://dx.doi.org/10.15540/nr.2.2.60.
Canterberry, M., Hanlon, C. A., Hartwell, K. J., Li, X., Owens, M., LeMatty, T., et al. (2013). Sustained reduction of nicotine craving with real-time neurofeedback: exploring the role of severity of dependence. Nicotine & Tobacco Research, 15(12), 2120e2124. http://dx.doi.org/10.1093/ntr/ntt122.
Caria, A., Sitaram, R., Veit, R., Begliomini, C., & Birbaumer, N. (2010). Volitional control of anterior insula activity modulates the response to aversive stimuli. A real-time functional magnetic resonance imaging study. Biological Psychiatry, 68, 425e432. http://dx.doi.org/10.1016/j.biopsych.2010.04.020.
Caria, A., Veit, R., Sitaram, R., Lotze, M., Weiskopf, N., Grodd, W., et al. (2007). Regulation of anterior insular cortex activity using real-time fMRI. NeuroImage, 35, 1238e1246. http://dx.doi.org/ 10.1016/j.neuroimage.2007.01.018.
deCharms, R. C. (2008). Applications of real-time fMRI. Nature Reviews. Neuroscience, 9(9), 720e729. http://dx.doi.org/10.1038/nrn2414.
deCharms, R. C., Christoff, K., Glover, G. H., Pauly, J. M., Whitfield, S., & Gabrieli, J. D. (2004). Learned regulation of spatially localized brain activation using real-time fMRI. NeuroImage, 21(1), 436e443. http://dx.doi.org/10.1016/j.neuroimage.2003.08.041.
deCharms, R. C., Maeda, F., Glover, G. H., Ludlow, D., Pauly, J. M., Soneji, D., et al. (2005). Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America, 102(51), 18626e18631. http://dx.doi.org/10.1073/pnas.0505210102.
Chiew, M., Laconte, S. M., & Graham, S. J. (2012). NeuroImage investigation of fMRI neurofeedback of differential primary motor cortex activity using kinesthetic motor imagery. NeuroImage, 61(1), 21e31. http://dx.doi.org/10.1016/j.neuroimage.2012.02.053.
Cordes, J. S., Mathiak, K. A., Dyck, M., Alawi, E. M., Gaber, T. J., Zepf, F. D., et al. (2015). Cognitive and neural strategies during control of the anterior cingulate cortex by fMRI neurofeedback in patients with schizophrenia. Frontiers in Behavioral Neuroscience, 9(June), 1e10. http://dx.doi.org/10.3389/fnbeh.2015.00169.
Cui, X., Bray, S., Bryant, D., Glover, G., & Reiss, A. (2011). A quantitative comparison of NIRS and fMRI across multiple cognitive tasks. NeuroImage, 54(4), 2808e2821. http://dx.doi.org/10.1016/j.neuroimage.2010.10.069.A.
Dar, R., Stronguin, F., & Etter, J.-F. (2005). Assigned versus perceived placebo effects in nicotine replacement therapy for smoking reduction in Swiss smokers. Journal of Consulting and Clinical Psychology, 73(2), 350e353. http://dx.doi.org/10.1037/ 0022-006X.73.2.350.
De Massari, D., Ruf, C. A., Furdea, A., Matuz, T., van der Heiden, L., Halder, S., et al. (2013). Brain communication in the locked-in state. Brain: A Journal of Neurology, 136(Pt 6), 1989e2000. http://dx.doi.org/10.1093/brain/awt102.
DeBettencourt, M. T., Cohen, J. D., Lee, R. F., Norman, K. a, & Turk-Browne, N. B. (2015). Closed-loop training of attention with real-time brain imaging. Nature Neuroscience, 18(3). http://dx.doi.org/10.1038/nn.3940.
Dworkin, B. R. (1988). Hypertension as a learned response: the baroreceptor reinforcement hypothesis. In T. Elbert,
W. Langosch, A. Steptoe, & D. Vaitl (Eds.), Behavioral medicine in cardiovascular disorders (pp. 17e47). Chichester, UK: Wiley.
Emmert, K., Breimhorst, M., Bauermann, T., Birklein, F., Van De Ville, D., & Haller, S. (2014). Comparison of anterior cingulated vs insular cortex as targets for real-time fMRI regulation during pain stimulation. Frontiers in Behavioral Neuroscience, 8(October), 350. http://dx.doi.org/10.3389/fnbeh.2014.00350.
Esmail, S., & Linden, D. (2014). Neural networks and neurofeedback in Parkinson's disease. NeuroRegulation, 1(3e4), 240e272. http://dx.doi.org/10.15540/nr.1.3-4.240.
Etkin, A., Egner, T., & Kalisch, R. (2011). Emotional processing in anterior cingulate and medial prefrontal. Trends in Cognitive Sciences, 15(2), 85e93. http://dx.doi.org/10.1016/j.tics.2010.11.004.
Ferrari, M., & Quaresima, V. (2012). A brief review on the history of human functional near-infrared spectroscopy (fNIRS) development and fields of application. NeuroImage, 63(2), 921e935. http://dx.doi.org/10.1016/j.neuroimage.2012.03.049.
Florin, E., Bock, E., & Baillet, S. (2014). Targeted reinforcement of neural oscillatory activity with real-time neuroimaging feedback. NeuroImage, 88, 54e60. http://dx.doi.org/10.1016/j.neuroimage.2013.10.028.
Fukuda, M., Mitsuo, K., & Hiroshi, I. (2015). Functional MRI neurofeedback training on connectivity induces long-lasting changes in intrinsic functional network. Frontiers in Human Neuroscience. http://dx.doi.org/10.3389/fnhum.2015.00160, 9(March).
Gallegos-Ayala, G., Furdea, A., Takano, K., Ruf, C. A., Flor, H., & Birbaumer, N. (2014). Brain communication in a completely locked-in patient using bedside near-infrared spectroscopy. Neurology, 82(21), 1930e1932. http://dx.doi.org/10.1111/j.1445-5994.2012.02896.x.
Garavan, H., Pendergrass, J. C., Ross, T. J., Stein, E. A., & Risinger, R. C. (2001). Amygdala response to both positively and negatively valenced stimuli. NeuroReport, 12(12), 2779e2783. http://dx.doi.org/10.1097/00001756-200108280-00036.
Greer, S. M., Trujillo, A. J., Glover, G. H., & Knutson, B. (2014). Control of nucleus accumbens activity with neurofeedback. NeuroImage, 96, 237e244. http://dx.doi.org/10.1016/j.neuroimage.2014.03.073.
Gr€one, M., Dyck, M., Koush, Y., Bergert, S., Mathiak, K. A., Alawi, E. M., et al. (2015). Upregulation of the rostral anterior cingulate cortex can alter the perception of emotions: fMRIbased neurofeedback at 3 and 7 T. Brain Topography, 28, 197e207. http://dx.doi.org/10.1007/s10548-014-0384-4.
Guan, M., Li, L., Tong, L., Zhang, Y., Zheng, D., Yan, B., et al. (2015). Self-regulation of rACC activation in patients with postherpetic neuralgia: a preliminary study using real-time fMRI neurofeedback. PLoS One, 10(4), e0123675. http://dx.doi.org/10.7910/DVN/27368.
Haller, S., Birbaumer, N., & Veit, R. (2010). Real-time fMRI feedback training may improve chronic tinnitus. European Radiology, 20(3), 696e703. http://dx.doi.org/10.1007/s00330-009-1595-z.
Hamann, S. B., Ely, T. D., Hoffman, J. M., & Kilts, C. D. (2002). Ecstasy and agony: activation of the human amygdala in positive and negative emotion. Psychological Science (Wiley-Blackwell), 13(2), 135.
Hamilton, J. P., Glover, G. H., Hsu, J.-J., Johnson, R. F., & Gotlib, I. H. (2011). Modulation of subgenual anterior cingulate cortex activity with real-time neurofeedback. Human Brain Mapping, 32(1), 22e31. http://dx.doi.org/10.1002/hbm.20997.
Hammond, D. C. (2005). Neurofeedback treatment of depression and anxiety. Journal of Adult Development, 12(2e3), 131e137. http://dx.doi.org/10.1007/s10804-005-7029-5.
Hammond, D. C. (2011). What is neurofeedback: an update. Journal of Neurotherapy, 15, 305e336. http://dx.doi.org/10.1080/10874208.2011.623090.
Hampson, M., Scheinost, D., Qiu, M., Bhawnani, J., Lacadie, C. M., Leckman, J. F., et al. (2011). Biofeedback of real-time functional magnetic resonance imaging data from the supplementary motor area reduces functional connectivity to subcortical regions. Brain Connectivity, 1(1), 91e98. http://dx.doi.org/10.1089/brain.2011.0002.
Hui, M., Zhang, H., Ge, R., Yao, L., & Long, Z. (2014). Modulation of functional network with real-time fMRI feedback training of right premotor cortex activity. Neuropsychologia, 62, 111e123. http://dx.doi.org/10.1016/j.neuropsychologia.2014.07.012.
Johnston, S., Linden, D. E. J., Healy, D., Goebel, R., Habes, I., & Boehm, S. G. (2011). Upregulation of emotion areas through neurofeedback with a focus on positive mood. Cognitive, Affective & Behavioral Neuroscience, 11(1), 44e51. http://dx.doi.org/10.3758/s13415-010-0010-1.
Kamiya, J. (2011). The first communications about operant conditioning of the EEG. Journal of Neurotherapy, 15(1), 65e73. http://dx.doi.org/10.1080/10874208.2011.545764.
Kanoh, S., Susila, I., & Miyamoto, K. (2011). The effect of neurofeedback training on cortical activity during motor imagery revealed by NIRS and fMRI. International Journal of Bioelectromagnetism, 13(2), 82e83.
Kaptchuk, T. J., Stason, W. B., Davis, R. B., Legedza, A. R. T., Schnyer, R. N., Kerr, C. E., et al. (2006). Sham device v inert pill:randomised controlled trial of two placebo treatments. BMJ, 1e7.
Kim, D.-Y., Yoo, S.-S., Tegethoff, M., Meinlshmidt, G., & Lee, J.-H. (2015). The inclusion of functional connectivity information into fMRI-based neurofeedback improves its efficacy in the reduction of cigarette cravings. Journal of Cognitive Neuroscience, 27(8), 1552e1572. http://dx.doi.org/10.1162/jocn.
Kober, S. E., Wood, G., Kurzmann, J., Friedrich, E. V. C., Stangl, M., Wippel, T., et al. (2014). Near-infrared spectroscopy based neurofeedback training increases specific motor imagery related cortical activation compared to sham feedback. Biological Psychology, 95, 21e30. http://dx.doi.org/10.1016/ j.biopsycho.2013.05.005.
Koralek, A. C., Jin, X., Long, J. D., Costa, R. M., & Carmena, J. M. (2012). Corticostriatal plasticity is necessary for learning intentional neuroprosthetic skills. Nature, 483(7389), 331e335. http://dx.doi.org/10.1038/nature10845.
Koush, Y., Rosa, M. J., Robineau, F., Heinen, K.,W., Rieger, S., Weiskopf, N., et al. (2013). Connectivity-based neurofeedback: dynamic causal modeling for real-time fMRI. NeuroImage, 81(1), 422e430. http://dx.doi.org/10.1016/j.neuroimage.2013.05.010.
Lal, T., Schr€oder, M., Hill, N., Preissl, H., Hinterberger, T., Mellinger, J., et al. (2005). A brain computer interface with online feedback based on magnetoencephalography. In Proceedings of the 22nd international Conference on Machine learning. Bonn, Germany.
Lansbergen, M. M., van Dongen-Boomsma, M., Buitelaar, J. K., & Slaats-Willemse, D. (2011). ADHD and EEG-neurofeedback: a double-blind randomized placebo-controlled feasibility study. Journal of Neural Transmission, 118(2), 275e284. http:// dx.doi.org/10.1007/s00702-010-0524-2.
Lawrence, E. J., Su, L., Barker, G. J., Medford, N., Dalton, J., Williams, S. C. R., et al. (2014). Self-regulation of the anterior insula: reinforcement learning using real-time fMRI neurofeedback. NeuroImage, 88(1), 113e124. http://dx.doi.org/10.1016/j.neuroimage.2013.10.069.
Leins, U., Goth, G., Hinterberger, T., Klinger, C., Rumpf, N., & Strehl, U. (2007). Neurofeedback for children with ADHD: a comparison of SCP and Theta/Beta protocols. Applied Psychophysiology and Biofeedback, 32, 73e88. http://dx.doi.org/10.1007/s10484-007-9031-0.
L_evesque, J., Beauregard, M., & Mensour, B. (2006). Neurofeedback training on the neural substrates of selective attention in children with attention-deficit/hyperactivity disorder: a functional magnetic resonance imaging. Neuroscience Letters, 301(3), 45e48. http://dx.doi.org/10.1016/j.neulet.2005.10.100.
Li, X., Hartwell, K. J., Borckardt, J., Prisciandaro, J. J., Saladin, M. E., Morgan, P. S., et al. (2012). Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology, 1e10.
Linden, D. E. J., Habes, I., Johnston, S. J., Linden, S., Tatineni, R., Subramanian, L., et al. (2012). Real-time self-regulation of emotion networks in patients with depression. PLoS One, 7(6), e38115. http://dx.doi.org/10.1371/journal.pone.0038115.
Lofthouse, N., Arnold, L. E., Hersch, S., Hurt, E., & DeBeus, R. (2012). A review of neurofeedback treatment for pediatric ADHD. Journal of Attention Disorders, 16(5), 351e372. http://dx.doi.org/10.1177/1087054711427530.
Logeman, H. N. A., Lansbergen, M. M., van Os, T. W. D. P., Bocker, K. B. E., & Kenemans, J. L. (2010). The effectiveness of EEG-feedback on attention, impulsivity and EEG: a sham feedback controlled study. Neuroscience Letters, 479, 49e53.
Lubar, J. F., Shabsin, H. S., Natelson, S. E., Holder, G. S., Whitsett, S. F., Pamplin, W. E., et al. (1981). EEG operant conditioning in intractable epileptics. Archives of Neurology, 38(11), 700e704.
Lubar, J. F., & Shouse, M. N. (1976). EEG and behavioral changes in a hyperkinetic child concurrent with training of the sensorimotor rhythm (SMR): a preliminary report. Biofeedback and Self-Regulation, 1(3), 293e306.
Margo, C. E. (1999). The placebo effect. Survey of Ophthamology, 44(1), 31e44.
Marx, A., Ehlis, A., Furdea, A., Holtmann, M., Banaschewski, T., Brandeis, D., et al. (2015). Near-infrared spectroscopy ( NIRS ) neurofeedback as a treatment for children with attention deficit hyperactivity disorder ( ADHD )d a pilot study. Frontiers in Behavioral Neuroscience, 8(January),, 1e13. http://dx.doi.org/10.3389/fnhum.2014.01038.
Mathiak, K. A., Alawi, E. M., Koush, Y., Dyck, M., Cordes, J. S., Gaber, T. J., et al. (2015). Social reward improves the voluntary control over localized brain activity in fMRI-based neurofeedback training. Frontiers in Behavioral Neuroscience, 9(June), 136. http://dx.doi.org/10.3389/fnbeh.2015.00136.
Mathiak, K. A., Koush, Y., Dyck, M., Gaber, T. J., Alawi, E., Zepf, F. D., et al. (2010). Social reinforcement can regulate localized brain activity. European Archives of Psychiatry and Clinical Neuroscience, 260, 132e136. http://dx.doi.org/10.1007/s00406-010-0135-9.
McCaig, R. G., Dixon, M., Keramatian, K., Liu, I., & Christoff, K. (2011). Improved modulation of rostrolateral prefrontal cortex using real-time fMRI training and meta-cognitive awareness. NeuroImage, 55(3), 1298e1305. http://dx.doi.org/10.1016/j.neuroimage.2010.12.016.
Mellinger, J., Schalk, G., Braun, C., Preissl, H., Rosenstiel, W., Birbaumer, N., et al. (2007). An MEG-based brain-computer interface (BCI). NeuroImage, 36(3), 581e593. http://dx.doi.org/10.1016/j.neuroimage.2007.03.019.
Mihara, M., Hattori, N., Hatakenaka, M., Yagura, H., Kawano, T., Hino, T., et al. (2013). Near-infrared spectroscopy-mediated neurofeedback enhances efficacy of motor imagery-based training in poststroke victims: A pilot study (pp. 1e8). Stroke.
Mihara, M., Miyai, I., Hattori, N., Hatakenaka, M., Yagura, H., Kawano, T., et al. (2012). Neurofeedback using real-time nearinfrared spectroscopy enhances motor imagery related cortical activation. PLoS One, 7(3), e32234. http://dx.doi.org/10.1371/journal.pone.0032234.
Moseley, J. B., O'Malley, K., Petersen, N. J., Menke, T. J., Brody, B. A., Kuykendall, D. H., et al. (2002). A controlled trial of arthroscopic surgery for osteoarthritis of the knee. The New England Journal of Medicine, 347(2), 81e88.
Nichols, A. L., & Maner, J. K. (2008). The good-subject effect: investigating participant demand characteristics. The Journal of General Psychology, 135(2), 151e166.
Ninaus, M., Kober, S. E., Witte, M., Koschutnig, K., Stangl, M., Neuper, C., et al. (2013). Neural substrates of cognitive control under the belief of getting neurofeedback training. Frontiers in Human Neuroscience, 7(December), 1e10. http://dx.doi.org/10.3389/fnhum.2013.00914.
Ogrim, G., & Hestad, K. A. (2013). Effects of neurofeedback versus stimulant medication in attention-deficit/hyperactivity disorder: a randomized pilot study. Journal of Child and Adolescent Psychopharmacology, 23(7), 448e457. http://dx.doi.org/10.1089/cap.2012.0090.
Okazaki, Y. O., Horschig, J. M., Luther, L., Oostenveld, R., Murakami, I., & Jensen, O. (2015). NeuroImage real-time MEG neurofeedback training of posterior alpha activity modulates subsequent visual detection performance. NeuroImage, 107, 323e332. http://dx.doi.org/10.1016/j.neuroimage.2014.12.014.
Paret, C., Klu¨ tsch, R., Ruf, M., Demirakca, T., H€osterey, S., Ende, G., et al. (2014). Down-regulation of amygdala activation with real-time fMRI neurofeedback in a healthy female sample. Frontiers in Behavioral Neuroscience, 8(September), 1e15. http://dx.doi.org/10.3389/fnbeh.2014.00299.
Perreau-Linck, E., Lessard, N., L_evesque, J., & Beauregard, M. (2010). Effects of neurofeedback training on inhibitory capacities in ADHD children: a single-blind, randomized, placebo-controlled study. Journal of Neurotherapy, 14(3), 229e242. http://dx.doi.org/10.1080/10874208.2010.501514.
Phillips, M. L., Young, A. W., Senior, C., Brammer, M., Andrew, C., Calder, A. J., et al. (1997 October). A specific neural substrate for perceiving facial expressions of disgust. Nature, 389, 495e498. http://dx.doi.org/10.1038/39051.
Posse, S., Fitzgerald, D., Gao, K., Habel, U., Rosenberg, D., Moore, G. J., et al. (2003). Real-time fMRI of temporolimbic regions detects amygdala activation during single-trial selfinduced sadness. NeuroImage, 18(3), 760e768. http://dx.doi.org/ 10.1016/S1053-8119(03)00004-1.
Ramos-Murguialday, A., Broetz, D., Rea, M., L€aer, L., Yilmaz, O., Brasil, F. L., et al. (2013). Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology, 74(1), 100e108. http://dx.doi.org/10.1002/ana.23879.
Rance, M., Ruttorf, M., Nees, F., Rudi Schad, L., & Flor, H. (2014). Real time fMRI feedback of the anterior cingulate and posterior insular cortex in the processing of pain. Human Brain Mapping, 5798(July), 5784e5798. http://dx.doi.org/10.1002/hbm.22585.
Raz, A., & Michels, R. (2007). Contextualizing specificity: specific and non-specific effects of treatment. American Journal of Clinical Hypnosis, 177e182 (October), http://dx.doi.org/10.1080/00029157.2007.10401614.
Rheims, S., Cucherat, M., Arzimanoglou, A., & Ryvlin, P. (2008). Greater response to placebo in children than in adults: a systematic review and meta-analysis in drug-resistant partial epilepsy. PLoS Medicine, 5(8), e166. http://dx.doi.org/10.1371/journal.pmed.0050166.
Robineau, F., Rieger, S. W., Mermoud, C., Pichon, S., Koush, Y., Van De Ville, D., et al. (2014). Self-regulation of interhemispheric visual cortex balance through real-time fMRI neurofeedback training. NeuroImage, 100, 1e14. http://dx.doi.org/10.1016/j.neuroimage.2014.05.072.
Ros, T., Th_eberge, J., Frewen, P. A., Kluetsch, R., Densmore, M., Calhoun, V. D., et al. (2013). Mind over chatter: plastic upregulation of the fMRI salience network directly after EEG neurofeedback. NeuroImage, 65, 324e335. http://dx.doi.org/10.1016/j.neuroimage.2012.09.046.
Rota, G., Handjaras, G., Sitaram, R., Birbaumer, N., & Dogil, G. (2011). Reorganization of functional and effective connectivity during real-time fMRI-BCI modulation of prosody processing. Brain and Language, 117(3), 123e132. http://dx.doi.org/10.1016/j.bandl.2010.07.008.
Rota, G., Sitaram, R., Veit, R., Erb, M., Weiskopf, N., Dogil, G., et al. (2009). Self-regulation of regional cortical activity using realtime fMRI: the right inferior frontal gyrus and linguistic processing. Human Brain Mapping, 30(5), 1605e1614. http://dx.doi.org/10.1002/hbm.20621.
Ruiz, S., Lee, S., Soekadar, S. R., Caria, A., Veit, R., Kircher, T., et al. (2013). Acquired self-control of insula cortex modulates emotion recognition and brain network connectivity in schizophrenia. Human Brain Mapping, 34(1), 200e212. http://dx.doi.org/10.1002/hbm.21427.
Sarkheil, P., Zilverstand, A., Kilian-Hu¨ tten, N., Schneider, F., Goebel, R., & Mathiak, K. (2015). fMRI feedback enhances emotion regulation as evidenced by a reduced amygdale response. Behavioural Brain Research, 281(0), 326e332. http://dx.doi.org/10.1016/j.bbr.2014.11.027.
Scharnowski, F., Hutton, C., Josephs, O., Weiskopf, N., & Rees, G. (2012). Improving visual perception through neurofeedback. The Journal of Neuroscience, 32(49), 17830e17841. http://dx.doi.org/10.1523/JNEUROSCI.6334-11.2012.
Scharnowski, F., Veit, R., Zopf, R., Studer, P., Bock, S., G€obel, R., et al. (2015). Manipulating motor performance and memory through neurofeedback. Biological Psychology, 108, 1e34. http://dx.doi.org/10.1016/j.biopsycho.2015.03.009.
Shapiro, A. K., & Shapiro, E. (1997). How blind is blind. In The powerful placebo: From ancient priest to modern physician (pp. 190e216). John Hopkins University Press.
Shen, J., Zhang, G., Yao, L., & Zhao, X. (2015). Real-time fMRI training-induced changes in regional connectivity mediating verbal working memory behavioral performance. Neuroscience, 289, 144e152. http://dx.doi.org/10.1016/j.neuroscience.2014.12.071.
Sitaram, R., Caria, A., Veit, R., Gaber, T., Rota, G., Kuebler, A., et al. (2007). FMRI brain-computer interface: a tool for neuroscientific research and treatment. Computational
Intelligence and Neuroscience, 2007, 25487. http://dx.doi.org/10.1155/2007/25487.
Sitaram, R., Caria, A., Veit, R., Gaber, T., Ruiz, S., & Birbaumer, N. (2014). Volitional control of the anterior insula in criminal psychopaths using real-time fMRI neurofeedback. A Pilot Study, 8(October), 1e13. http://dx.doi.org/10.3389/fnbeh.2014.00344.
Sitaram, R., Zhang, H., Guan, C., Thulasidas, M., Hoshi, Y., Ishikawa, A., et al. (2007). Temporal classification of multichannel near-infrared spectroscopy signals of motor imagery for developing a brain-computer interface. NeuroImage, 34(4), 1416e1427. http://dx.doi.org/10.1016/j.neuroimage.2006.11.005.
Sonuga-Barke, E. J. S., Brandeis, D., Cortese, S., Daley, D., Ferrin, M., Holtmann, M., et al. (2013). Nonpharmacological interventions for ADHD: systematic review and meta-analyses of randomized controlled trials of dietary and psychological treatments. The American Journal of Psychiatry, 170(3), 275e289.
http://dx.doi.org/10.1176/appi.ajp.2012.12070991.
Sterman, M., & Friar, L. (1972). Suppression of seizures in an epileptic following sensorimotor EEG feedback training. Electroencephalography and Clinical Neurophysiology, 33, 89e95.
Sterman, M., & MacDonald, L. (1978). Effects of central cortical EEG feedback training on incidence of poorly controlled seizures. Epilepsia, 19, 207e222.
Strehl, U., Leins, U., Goth, G., Klinger, C., Hinterberger, T., & Birbaumer, N. (2006). Self-regulation of slow cortical potentials: a new treatment for children with attentiondeficit/hyperactivity disorder. Pediatrics, 118(5), e1530ee1540. http://dx.doi.org/10.1542/peds.2005-2478.
Subramanian, L., Hindle, J. V., Johnston, S., Roberts, M. V., Husain, M., Goebel, R., et al. (2011). Real-time functional magnetic resonance imaging neurofeedback for treatment of Parkinson's disease. The Journal of Neuroscience, 31(45), 16309e16317. http://dx.doi.org/10.1523/JNEUROSCI.3498-11.2011.
Sulzer, J., Haller, S., Scharnowski, F., Weiskopf, N., Birbaumer, N., Blefari, M. L., et al. (2013). Real-time fMRI neurofeedback: progress and challenges. NeuroImage, 76(1), 386e399. http:// dx.doi.org/10.1016/j.neuroimage.2013.03.033.
Sulzer, J., Sitaram, R., Blefari, M. L., Kollias, S., Birbaumer, N., Stephan, K. E., et al. (2013). Neurofeedback-mediated selfregulation of the dopaminergic midbrain. NeuroImage, 83(1), 817e825. http://dx.doi.org/10.1016/j.neuroimage.2013.05.115.
Tan, G., Thornby, J., Hammond, D. C., Strehl, U., Canady, B., Arnemann, K., et al. (2009). Meta-analysis of EEG biofeedback in treating epilepsy. Clinical EEG and Neuroscience, 40(3), 173e179. http://dx.doi.org/10.1177/155005940904000310.
Thibault, R. T., Lifshitz, M., Birbaumer, N., & Raz, A. (2015). Neurofeedback, self-regulation, and brain imaging: clinical science and fad in the service of mental disorders. Psychotherapy and Psychosomatics, 84(4), 193e207. http:// dx.doi.org/10.1159/000371714.
Van Dongen-Boomsma, M., Vollebregt, M. A., Slaats-Willemse, D., & Buitelaar, J. K. (2013 August). A randomized placebocontrolled trial of electroencephalographic (EEG) neurofeedback in children with attention-deficit/hyperactivity disorder. Journal of Clinical Psychiatry, 74, 821e827. http://dx.doi.org/10.4088/JCP.12m08321.
Vollebregt, M. A., van Dongen-Boomsma, M., Buitelaar, J. K., & Slaats-Willemse, D. (2014). Does EEG-neurofeedback improve neurocognitive functioning in children with attention-deficit/hyperactivity disorder? A systematic review and a doubleblind placebo-controlled study. Journal of Child Psychology and Psychiatry, and Allied Disciplines, 55(5), 460e472. http://dx.doi.org/10.1111/jcpp.12143.
Waber, R., Shiv, B., Carmon, Z., & Ariely, D. (2008). Commercial features of placebo and therapeutic efficacy. Journal of the American Medical Association, 299(9), 1016e1017.
Wampold, B. E., Minami, T., Tierney, S. C., Baskin, T. W., & Bhati, K. S. (2005). The placebo is powerful: estimating placebo effects in medicine and psychotherapy from randomized clinical trials. Journal of Clinical Psychology, 61(7), 835e854. http://dx.doi.org/10.1002/jclp.20129.
Weiskopf, N. (2012). Real-time fMRI and its application to neurofeedback. NeuroImage, 62(2), 682e692. http://dx.doi.org/10.1016/j.neuroimage.2011.10.009.
Weiskopf, N., Sitaram, R., Josephs, O., Veit, R., Scharnowski, F., Goebel, R., et al. (2007). Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging, 25(6), 989e1003. http://dx.doi.org/10.1016/j.mri.2007.02.007.
Weiskopf, N., Veit, R., Erb, M., Mathiak, K., Grodd,W., Goebel, R., et al. (2003). Physiological self-regulation of regional brain activity using real-time functional magnetic resonance imaging (fMRI): methodology and exemplary data. NeuroImage, 19(3), 577e586. http://dx.doi.org/10.1016/S1053-8119(03)00145-9.
Wicker, B., Keysers, C., Plailly, J., Royet, J. P., Gallese, V., & Rizzolatti, G. (2003). Both of us disgusted in My insula: the common neural basis of seeing and feeling disgust. Neuron, 40(3), 655e664. http://dx.doi.org/10.1016/S0896-6273(03)00679-2.
Wyrwicka, W., & Sterman, M. B. (1968). Instrumental conditioning of sensorimotor cortex EEG spindles in the waking cat. Physiology & Behavior, 3(5), 703e707. http://dx.doi.org/10.1016/0031-9384(68)90139-X.
Yang, T. T., Menon, V., Eliez, S., Blasey, C., White, C. D., Reid, A. J., et al. (2002). Amygdalar activation associated with positive and negative facial expressions. NeuroReport, 13(14), 1737e1741. http://dx.doi.org/10.1097/00001756-200210070-00009.
Yoo, S.-S., Lee, J.-H., O'Leary, H., Panych, L. P., & Jolesz, F. A. (2008). Neurofeedback fMRI-mediated learning and consolidation of regional brain activation during motor imagery. International Journal of Imaging Systems and Technology, 18(1), 69e78. http://dx.doi.org/10.1002/ima.20139.
Young, K. D., Zotev, V., Phillips, R., Misaki, M., Yuan, H., Drevets, W. C., et al. (2014). Real-time FMRI neurofeedback training of amygdala activity in patients with major depressive disorder. PLoS One, 9(2), e88785. http://dx.doi.org/10.1371/journal.pone.0088785.
Zhang, G., Yao, L., Shen, J., Yang, Y., & Zhao, X. (2014). Reorganization of functional brain networks mediates the improvement of cognitive performance following real-time neurofeedback training of working memory. Human Brian Mapping. http://dx.doi.org/10.1002/hbm.22731 (December).
Zhang, G., Yao, L., Zhang, H., Long, Z., & Zhao, X. (2013). Improved working memory performance through self-regulation of dorsal lateral prefrontal cortex activation using real-time fMRI. PLoS One, 8(8), e73735. http://dx.doi.org/10.1371/journal.pone.0073735.
Zhang, G., Zhang, H., Li, X., Zhao, X., Yao, L., & Long, Z. (2013). Functional alteration of the DMN by learned regulation of the PCC using real-time fMRI. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 21(4), 595e606. http://dx.doi.org/10.1109/TNSRE.2012.2221480.
Zilverstand, A., Sorger, B., Sarkheil, P., & Goebel, R. (2015). fMRI neurofeedback facilitates anxiety regulation in females with spider phobia. Frontiers in Behavioral Neuroscience, 9(June), 1e12. http://dx.doi.org/10.3389/fnbeh.2015.00148.
Zotev, V., Krueger, F., Phillips, R., Alvarez, R. P., Simmons, W. K., Bellgowan, P., et al. (2011). Self-regulation of amygdale activation using real-time FMRI neurofeedback. PLoS One, 6(9), e24522. http://dx.doi.org/10.1371/journal.pone.0024522.
Zotev, V., Phillips, R., Young, K. D., Drevets, W. C., & Bodurka, J. (2013). Prefrontal control of the amygdala during real-time fMRI neurofeedback training of emotion regulation. PLoS One, 8(11), e79184. http://dx.doi.org/10.1371/journal.pone.0079184.
Zotev, V., Phillips, R., Yuan, H., Misaki, M., & Bodurka, J. (2013). Self-regulation of human brain activity using simultaneous real-time fMRI and EEG neurofeedback. NeuroImage, 85, 985e995. http://dx.doi.org/10.1016/j.neuroimage.2013.04.126.
Zuberer, A., Brandeis, D., & Drechsler, R. (2015 March). Are treatment effects of neurofeedback training in children with ADHD related to the successful regulation of brain activity? A review on the learning of regulation of brain activity and a contribution to the discussion on specificity. Frontiers in Human Neuroscience, 9, 1e15. http://dx.doi.org/10.3389/fnhum.2015.00135.